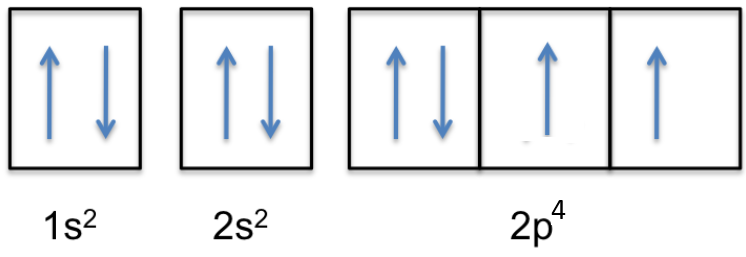
Các hạt cấu tạo nên hầu hết nguyên tử là
Đáp án đúng là: D
Dựa vào lý thuyết về cấu tạo nguyên tử.
Đáp án cần chọn là: D
Phát biểu nào sau đây không đúng?
Đáp án đúng là: A
Dựa vào lý thuyết về cấu tạo nguyên tử.
Đáp án cần chọn là: A
Các phân lớp trong mỗi lớp electron được kí hiệu bằng các chữ cái viết thường theo thứ tự là
Đáp án đúng là: C
Số lượng và kí hiệu các phân lớp trong một lớp
Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf,…Cụ thể
+ Lớp K, n = 1 có 1 phân lớp, được kí hiệu là 1s
+ Lớp L, n = 2 có 2 phân lớp, được kí hiệu là 2s và 2p.
+ Lớp M, n = 3 có 3 phân lớp, được kí hiệu là 3s và 3p và 3d.
Đáp án cần chọn là: C
Phần lớn các nguyên tố hóa học trong bảng tuần hoàn là
Đáp án đúng là: A
Dựa vào lý thuyết về bảng tuần hoàn.
Đáp án cần chọn là: A
Giá trị điện tích và khối lượng nào sau đây là của hạt proton?
Đáp án đúng là: D
Giá trị điện tích và khối lượng của các hạt trong nguyên tử.
Đáp án cần chọn là: D
Phát biểu nào sau đây không đúng?
Đáp án đúng là: B
Dựa vào lý thuyết về bảng tuần hoàn.
Đáp án cần chọn là: B
Oxide nào sau đây có tính base mạnh nhất ?
Đáp án đúng là: A
Trong một chu kì theo, chiều tăng dần điện tích hạt nhân tính base của các oxide cao nhất có xu hướng giảm dần.
Đáp án cần chọn là: A
Sắp xếp các phân lớp sau theo thứ tự phân mức năng lượng tăng dần
Đáp án đúng là: C
Thứ tự các mức năng lượng từ thấp đến cao.
1s 2s 3s 3p 4s 3d 4p…
Đáp án cần chọn là: C
Phát biểu nào sau đây là đúng?
Đáp án đúng là: A
Trong một nhóm A, theo chiều tăng dần điện tích hạt nhân, độ âm điện giảm dần.
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, tính kim loại giảm dần.
Oxide cao nhất của một nguyên tố là oxide mà trong đó hóa trị của nguyên tố đó là cao nhất.
Đáp án cần chọn là: A
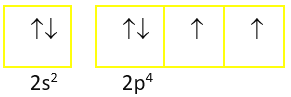
Ở trạng thái cơ bản, số electron đã ghép đôi và số electron độc thân trong nguyên tử oxygen lần lượt là
Đáp án đúng là: C
- Viết cấu hình electron nguyên tử
- Biểu diễn mỗi AO bằng một ô vuông (ô orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các orbital từ trái qua phải theo thứ tự cấu hình electron
- Điền electron vào từng orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn một mũi tên. Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các orbital theo thứ tự từ trái qua phải. Trong một orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
Đáp án cần chọn là: C
Cho các nguyên tử sau: B (Z = 8, A = 16), D (Z = 9, A = 19), E (Z = 8, A = 18), G (Z = 7, A = 15). Các nguyên tử thuộc cùng một nguyên tố hoá học là
Đáp án đúng là: B
Dựa vào lý thuyết về nguyên tố hoá học.
Đáp án cần chọn là: B
X được dùng làm chất bán dẫn trong kĩ thuật vô tuyến, chế tạo pin mặt trời. Nguyên tử của nguyên tố X có 3 lớp electron, lớp ngoài cùng có 4 electron. Cấu hình electron của X là
Đáp án đúng là: C
Dựa vào lý thuyết về cấu hình electron nguyên tử.
Đáp án cần chọn là: C
Trong các hydroxide của các nguyên tố chu kỳ 3, acid mạnh nhất là
Đáp án đúng là: C
Trong 1 chu kì, theo chiều tăng dần điện tích hạt nhân, tính acid của các hydroxide có xu hướng tăng dần, tính base của chúng có xu hướng giảm dần.
Đáp án cần chọn là: C
Nguyên tố có Z = 16 thuộc loại khối nguyên tố nào?
Đáp án đúng là: B
Dựa vào lý thuyết về mối liên hệ giữa cấu hình electron và vị trí của nguyên tố trong BTH.
Đáp án cần chọn là: B
Cấu hình orbital nào sau đây viết đúng?
Đáp án đúng là: B
Dựa vào lý thuyết về cấu hình orbital nguyên tử.
Đáp án cần chọn là: B
A và B là hai nguyên tố ở cùng một chu kỳ nhỏ và thuộc hai nhóm A liên tiếp trong bảng tuần hoàn (ZA < ZB). Tổng số proton trong hai hạt nhân nguyên tử của A và B bằng 19. Cấu hình electron nguyên tử của B là
Đáp án đúng là: C
- Lập hệ phương trình biểu thị mối liên hệ Tổng số proton trong hai hạt nhân nguyên tử của A và B và mối liên hệ giữa A, B ở hai nhóm A liên tiếp trong cùng một chu kì
- Giải hệ phương trình ⟹ nguyên tố A, B
⟹ Cấu hình electron nguyên tử của B là
Đáp án cần chọn là: C
Cho phổ khối lượng của zirconium như sau:
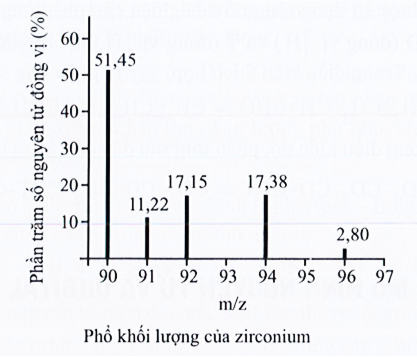
Nguyên tử khối trung bình của zirconium là
Đáp án đúng là: B
Dựa vào lý thuyết về nguyên tử khối trung bình.
Đáp án cần chọn là: B
Ion XY2- có tổng số hạt mang điện âm là 30. Trong đó số hạt mang điện của X nhiều hơn của Y là 10. Phát biểu nào sau đây đúng?
Đáp án đúng là: B
Dựa vào lý thuyết về mối liên hệ giữa cấu hình electron nguyên tử của nguyên tố và vị trí của nguyên tố trong BTH.
Đáp án cần chọn là: B
Cho 3 nguyên tố Mg (Z = 12), H (Z = 1) và O (Z = 8)
| Đúng | Sai | |
|---|---|---|
| a) Theo quy tắc octet để đạt được cấu hình bền như khí hiếm, Mg có xu hướng nhường 2e và O có xu hướng nhận 2e ở lớp ngoài cùng. | ||
| b) Liên kết giữa Mg và O là liên kết cộng hóa trị phân cực. | ||
| c) H và O tạo được hợp chất cộng hóa trị có công thức cấu tạo là H = O = H | ||
| d) Phân tử O2 được hình thành từ sự xen phủ trục pp và xen phủ bên pp. |
Đáp án đúng là: Đ; S; S; Đ
a) Trong quá trình hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt được cấu hình electron bền vững như của khí hiếm với 8 electron lớp ngoài cùng (hoặc 2 electron ở lớp ngoài cùng như helium).
- Nguyên tử kim loại có xu hướng nhường electron để hình thành ion dương.
- Nguyên tử phi kim có xu hướng nhận electron để hình thành ion âm.
b) Liên kết ion được hình thành từ kim loại điển hình và phi kim điển hình.
c) Công thức cấu tạo của H2O.
d) Sự hình thành liên kết trong hợp chất cộng hoá trị.
Đáp án cần chọn là: Đ; S; S; Đ
Nguyên tử của nguyên tố potassium (K) có cấu hình electron là [Ar]4s1
| Đúng | Sai | |
|---|---|---|
| a) Nguyên tử potassium có 19 electron. | ||
| b) Hydroxide của nguyên tố potassium là KOH; KOH thể hiện tính base mạnh. | ||
| c) Khi tham gia liên kết hóa học, nguyên tử potassium có xu hướng nhận 1 electron tạo ion K+. | ||
| d) So với các nguyên tố trong cùng chu kì, potassium có bán kính nguyên tử nhỏ nhất. |
Đáp án đúng là: Đ; Đ; S; S
a) Từ cấu hình electron ⟹ số electron
b) Hydroxide của nguyên tố potassium.
c) Nguyên tử kim loại có xu hướng nhường electron để hình thành ion khi hình thành liên kết hoá học.
d) Trong 1 chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử giảm dần.
Đáp án cần chọn là: Đ; Đ; S; S
Cho biết cấu hình electron của X: 1s22s22p63s23p3, của Y là 1s22s22p63s23p64s1.
| Đúng | Sai | |
|---|---|---|
| a) Số electron ở lớp ngoài cùng của X, Y lần lượt là 3 và 1. | ||
| b) Số lớp electron của X, Y lần lượt là 3, 4. | ||
| c) Ion X3- và Y+ đều có cấu hình electron 1s22s22p63s23p6. | ||
| d) Số hạt mang điện của Y nhiều hơn X là 4. |
Đáp án đúng là: S; Đ; Đ; S
Dựa vào lí thuyết về phân lớp, lớp và cấu hình electron nguyên tử.
Đáp án cần chọn là: S; Đ; Đ; S
Hình bên mô tả ô nguyên tố của copper (đồng) trong bảng tuần hoàn các nguyên tố hóa học. Thông tin thu được từ ô nguyên tố này là:

| Đúng | Sai | |
|---|---|---|
| a) Đồng có kí hiệu là Cu, nguyên tử có 29 proton, nguyên tử khối trung bình là 63,546. |
||
| b) Đồng và các hợp chất của đồng có kí hiệu là Cu, số hiệu nguyên tử là 29, nguyên tử khối trung bình là 63,546. |
||
| c) Đồng và các hợp chất của đồng có kí hiệu là Cu, số hiệu nguyên tử là 29, đồng có hai đồng với số khối là 63 và 64. |
||
| d) Đồng có kí hiệu là Cu, số hiệu nguyên tử là 29, có hai đồng vị với số khối là 63 và 64. |
Đáp án đúng là: Đ; S; S; S
Đặc điểm ô nguyên tố.
Đáp án cần chọn là: Đ; S; S; S
Một nguyên tử nitrogen có 7 electron và 7 neutron. Khối lượng của nguyên tử nitrogen này là bao nhiêu?
Đáp án đúng là:
Khối lượng nguyên tử = khối lượng proton + khối lượng neutron = số p + số n (amu)
Đáp án cần điền là: 14
Cho số điện tích hạt nhân của nguyên tử là: X (Z = 6); Y (Z = 7); M (Z = 13); T (Z = 18); Q (Z = 19). Có bao nhiêu nguyên tố có tính kim loại?
Đáp án đúng là:
Từ số hiệu nguyên tử viết được cấu hình electron của các nguyên tố.
Xác định các nguyên tố kim loại: Kim loại là các nguyên tố có 1, 2, 3 electron ở lớp ngoài cùng (trừ H, He, B).
Đáp án cần điền là: 2
Trong tự nhiên chlorine có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của chlorine là 35,5. Tính thành phần % khối lượng của 37Cl trong KClO3 (cho K = 39; O = 16)?
Đáp án đúng là:
Dựa vào lý thuyết về nguyên tử khối trung bình.
Đáp án cần điền là: 7,55
Oxide cao nhất của một nguyên tố có dạng R2O5. Hợp chất khí với hydrogen của nguyên tố này chứa 8,82% hydrogen về khối lượng. Trong bảng tuần hoàn các nguyên tố hóa học, R thuộc chu kì mấy?
Đáp án đúng là:
Oxide cao nhất của một nguyên tố có dạng R2O5 ⟹ Hợp chất khí với H có dạng RH3.
Từ phần trăm khối lượng của H trong RH3 suy ra MR.
Xác định nguyên tố, suy ra số hiệu nguyên tử.
Viết cấu hình e của R, suy ra số thứ tự chu kì.
Đáp án cần điền là: 3
Cho 84 gam muối MCO3 tác dụng hết với dung dịch HCl dư thu được dung dịch chứa 93,24 gam muối và V lít khí CO2 (đkc). Tính V? (Làm tròn đến sau dấu phẩy một chữ số)
Đáp án đúng là:
MCO3 + 2HCl ⟶ MCl2 + CO2 + H2O
Theo PTHH:$n_{MCO_{3}} = n_{MCl_{2}}$. Lập tỉ lệ về số mol theo khối lượng và phân tử khối.
⟹ Nguyên tử khối M ⟹ Mol MCO3 ⟹ Mol CO2 ⟹ V
Đáp án cần điền là: 20,8
Nguyên tử X có 2 lớp electron, lớp thứ 2 có 6 electron. Số hiệu nguyên tử của X là bao nhiêu?
Đáp án đúng là:
Viết cấu hình electron nguyên tử X ⟹ Số electron
Số hiệu nguyên tử = số đơn vị điện tích hạt nhân = số proton = số electron.
Đáp án cần điền là: 8