Đề thi học kì I môn hóa 11 trường THPT Đa Phúc mã 103 năm 2012-2013
Thời gian thi : 45 phút - Số câu hỏi : 9 câu - Số lượt thi : 2249
Chú ý: Để xem lời giải chi tiết vui lòng chọn "Click vào đề thi"
Một số câu hỏi trong đề thi
Câu 1: Người ta sản xuất khí nitơ trong công nghiệp bằng cách nào sau đây?
Câu 2: Cho các chất sau: Na2CO3, Fe(OH)2, CuO, Al, Au, ZnCl2. Số chất tác dụng được với dung dịch HNO3 loãng là:
Câu 3: Hấp thụ hết 5,6 lít khí CO2 (đktc) vào 300ml dung dịch NaOH 1M. Dung dịch thu được sau phản ứng chứa chất nào sau đây :
Câu 4: Trộn 200 ml dung dịch HCl 0,275M với 300 ml dung dịch chứa hỗn hợp NaOH 0,1M và Ba(OH)2 0,05M. Giá trị pH của dung dịch sau phản ứng là:
Câu 5: Chọn những chất điện li mạnh trong số các chất sau:
a. NaOH b. BaCl2 c. HNO3 d. Mg(OH)2 e. HCl f. CH3COOH
Câu 6: Chất nào sau đây ở trạng thái rắn, gọi ”là nước đá khô”:
Câu 7: Tự luận
Viết các phương trình hóa học của các phản ứng sau (ghi rừ điều kiện phản ứng nếu có): (2,5 đ)
a) AgNO3 + FeCl3 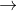
b) Al(OH)3 + NaOH 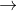
c) C + Al 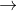
d) Mg + HNO3 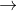 tỉ lệ mol N2O: NO2 = 1:2
tỉ lệ mol N2O: NO2 = 1:2
Viết phương trình ion rút gọn của phản ứng a) và b)
Câu 8: Trình bày phương pháp hoá học phân biệt các dung dịch đựng trong các lọ mất nhãn riêng biệt sau (Viết các PTHH xảy ra nếu có): (1,5 đ)
NH4Cl, Ca(NO3)2, K2SO4, Na2CO3
Câu 9: Hòa tan hoàn toàn 12,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch HNO3 lõang vừa đủ. Sau phản ứng thu được dung dịch Y và 6,72 lít khí NO (đktc, là sản phẩm khử duy nhất).
a) Tính % khối lượng mỗi kim loại trong hỗn hợp X. (1,5 đ)
b) Cô cạn dung dịch Y rồi nung đến khối lượng không đổi thu được m gam chất rắn. Tính giá trị của m. (1,0 đ)
c) Trộn ½ lượng hỗn hợp X với bột lưu huỳnh vừa đủ rồi nung nóng đến phản ứng hoàn toàn thu được hỗn hợp Z. Hòa tan hết Z vào dung dịch chứa lượng dư hỗn hợp NaNO3 và HCl. Sau phản ứng thu được V lít khí NO duy nhất. Tính V. (0,5 đ)
(Cho biết: Mg =24 ; Fe=56 ; H=1 ; N=14, O=16, S=32)