
Mối quan hệ giữa tốc độ phản ứng thuận vt và tốc độ phản ứng nghịch vn ở trạng thái cân bằng được biểu diễn như thế nào?
Đáp án đúng là: B
Dựa vào khái niệm trạng thái cân bằng.
Đáp án cần chọn là: B
Phú dưỡng là hệ quả sau khi ao hồ, sông ngòi nhận quá nhiều các nguồn thải chứa các chất dinh dưỡng chứa nguyên tố nào sau đây?
Đáp án đúng là: B
Dựa vào lý thuyết hiện tượng phú dưỡng.
Đáp án cần chọn là: B
Theo thuyết Bronsted – Lowry, base là những chất có khả năng
Đáp án đúng là: A
Thuyết Bronsted – Lowry về acid/ base.
Đáp án cần chọn là: A
Hệ cân bằng sau được thực hiện trong bình kín:
$SO_{2}(g) + O_{2}(g)\overset{V_{2}O_{5},t^{0}}{\rightleftharpoons}SO_{3}(g)\,\,\,\,\,\,\,\Delta_{r}H_{298}^{0} < 0$
Yếu tố nào sau đây làm cân bằng hóa học chuyển dịch sang chiều thuận?
Đáp án đúng là: D
- Ảnh hưởng của nhiệt độ: khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ và ngược lại.
- Ảnh hưởng của nồng độ: khi tăng nồng độ một chất trong phản ứng thì cân bằng hóa học bị phá vỡ và chuyển dịch theo chiều làm giảm nồng độ của chất đó và ngược lại.
- Ảnh hưởng của áp suất: khi tăng áp suất chung của hệ, thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức là chiều làm giảm số mol khí và ngược lại. Áp suất chỉ ảnh hưởng khi có chất khí tham gia.
- Chất xúc tác làm tăng tốc độ phản ứng nhưng không làm chuyển tích cân bằng.
Đáp án cần chọn là: D
Sulfur dioxide là tác nhân gây ô nhiễm không khí. Nó được sinh ra từ nguồn tự nhiên và nhân tạo. Nguồn nào sau đây không sinh ra sulfur dioxide?
Đáp án đúng là: A
Dựa vào lí thuyết về nguồn phát thải khí SO2.
Đáp án cần chọn là: A
Tính base của ammonia được thể hiện qua phản ứng nào sau đây?
Đáp án đúng là: A
Dựa vào tính chất hoá học của NH3.
Đáp án cần chọn là: A
Sự phá vỡ cân bằng cũ để chuyển sang một cân bằng mới do các yếu tố bên ngoài tác động được gọi là
Đáp án đúng là: B
Dựa vào khái niệm sự chuyển dịch cân bằng.
Đáp án cần chọn là: B
Dãy chất nào sau đây, trong nước đều là chất điện li mạnh ?
Đáp án đúng là: D
Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion. (acid mạnh, base mạnh và hầu hết các muối).
Đáp án cần chọn là: D
Phát biểu nào sau đây đúng khi nói về tính chất hoá học của sulfur?
Đáp án đúng là: A
Tính chất hóa học của sulfur.
Đáp án cần chọn là: A
Khi có tia lửa điện trong các cơn mưa, trong không khí nitrogen sẽ tác dụng được với oxygen tạo khí X. Khí X sẽ chuyển hóa thành nitrate, cung cấp một lượng phân đạm cho cây trồng. Khí X là hóa chất nào sau đây?
Đáp án đúng là: D
Dựa vào lí thuyết về nitrogen.
Đáp án cần chọn là: D
Dịch dạ dày với pH= 1,5- 3,5 có môi trường gì?
Đáp án đúng là: C
Dựa vào thang pH.
Đáp án cần chọn là: C
Hóa chất dùng để điều chế HNO3 trong phòng thí nghiệm là:
Đáp án đúng là: B
Dựa vào lý thuyết về phương pháp điều chế HNO3 trong phòng thí nghiệm.
Đáp án cần chọn là: B
Cho phản ứng sau ở trạng thái cân bằng:
H2 (g) + F2 (g) $\underset{}{\overset{}{\rightleftharpoons}}$ 2HF (g) $\Delta_{r}H_{298}^{o}$< 0.
Sự biến đổi nào sau đây không làm chuyển dịch cân bằng hoá học?
Đáp án đúng là: A
Dựa vào các yếu tố ảnh hưởng tới cân bằng hóa học.
Đáp án cần chọn là: A
Sulfuric acid đặc thể hiện tính chất nào khi lấy nước từ hợp chất carbohydrate và khiến chúng hóa đen?
Đáp án đúng là: C
Dựa vào lí thuyết về H2SO4 đặc.
Đáp án cần chọn là: C
Trộn 250 mL dung dịch chứa hỗn hợp HNO3 0,08M với 250 mL dung dịch NaOH 0,1 M thu được dung dịch có pH bằng
Đáp án đúng là: B
Tính pH của dung dịch sau phản ứng.
Nếu nOH- > nH+ ⟶ base dư ⟶ pH = 14 + log(\(\dfrac{{{n_{O{H^ - }}} - {n_{{H^ + }}}}}{{{V_{{\rm{dd}}sau}}}}\))
Nếu nOH- = nH+ ⟶ phản ứng vừa đủ ⟶ pH = 7.
Nếu nOH- < nH+ ⟶ acid dư ⟶ pH = - log(\(\dfrac{{{n_{{H^ + }}} - {n_{O{H^ - }}}}}{{{V_{{\rm{dd}}sau}}}}\))
Đáp án cần chọn là: B
Cho sơ đồ chuyển hoá sau: X $\overset{~ + ~O_{2}}{\rightarrow}$ Y $\overset{~ + ~O_{2}}{\rightarrow}~$ Z $~\overset{+ H_{2}O~ + ~O_{2}}{\rightarrow}$ W. Biết rằng, X, Y, Z, W đều chứa nitrogen; X và W có thể phản ứng với nhau tạo thành muối tan trong nước. Chất X phù hợp với sơ đồ trên là
Đáp án đúng là: D
Dựa vào tính chất hóa học của nitrogen và hợp chất.
Đáp án cần chọn là: D
Người ta 16kg lưu huỳnh để tạo thành sulfur dioxide, giả thiết hiệu suất phản ứng đạt 80%.
Giả thiết có 20% lượng khí SO2 tạo ra khuếch tán vào khí quyển rồi bị chuyển hoá thành H2SO4 trong nước mưa theo sơ đồ: $\text{SO}_{2}\underset{\ }{\overset{+ \text{O}_{2}}{\rightarrow}}\text{SO}_{3}\overset{+ \text{H}_{2}\text{O}}{\rightarrow}\text{H}_{2}\text{SO}_{4}$
Trả lời cho các câu 17, 18 dưới đây:
Nếu nồng độ H2SO4 trong nước mưa là 1.10-5M thì thể tích nước mưa bị nhiễm acid là bao nhiêu m3?
Đáp án đúng là: C
Tính nS $\rightarrow$nH2SO4 = nSO2
Vnước mưa = $\dfrac{n_{H2SO4}}{C_{M}}$
Đáp án cần chọn là: C
Toàn bộ lượng acid trong nước mưa ăn mòn tối đa bao nhiêu kg CaCO3 ở các công trình kiến trúc bằng đá?
Đáp án đúng là: D
nCaCO3 = nH2SO4 $\rightarrow$ mCaCO3
Đáp án cần chọn là: D
Thí nghiệm nghiên cứ ảnh hưởng của nồng độ đến sự chuyển dịch cân bằng:
CH3COONa + H2O ⇌ CH3COOH + NaOH; ΔrHo > 0.
Bước 1: Cho một vài giọt phenolphthalein vào dung dịch CH3COONa, lắc đều.
Bước 2: Chia dung dịch thu được vào ba ống nghiệm với thể tích gần bằng nhau Ống nghiệm (1) để so sánh, ống nghiệm (2) thêm vài tinh thể CH3COONa, ống nghiệm (3) thêm một vài giọt dung dịch CH3COOH.
| Đúng | Sai | |
|---|---|---|
| a) Ở bước 1, khi cho vài giọt phenolphathalein vào dung dịch CH3COONa thu được dung dịch có màu hồng. | ||
| b) Ở bước 2, khi thêm vài tinh thể CH3COONa vào ống nghiệm (2), cân bằng chuyển dịch theo chiều nghịch, màu nhạt hơn so với ống nghiệm (1). | ||
| c) Ở bước 2, khi thêm vài giọt dung dịch CH3COOH vào ống nghiệm (3), cân bằng chuyển dịch theo chiều nghịch, màu đậm hơn so với ống nghiệm (1). | ||
| d) Khi tăng hoặc giảm nồng độ một chất trong hệ cân bằng, cân bằng không chuyển dịch. Vì vậy, màu ống nghiệm (2) và (3) không đổi so với ống nghiệm (1). |
Đáp án đúng là: Đ; S; S; S
Dung dịch có môi trường base làm phenolphthalein chuyển hồng.
Các yếu tố ảnh hưởng đến cân bằng hoá học: nồng độ, nhiệt độ, áp suất.
Nguyên lí chuyển dịch Le Chatelier: Cân bằng chuyển dịch theo chiều chống lại tác nhân bên ngoài.
Đáp án cần chọn là: Đ; S; S; S
Tiến hành thí nghiệm theo các bước sau:
Bước 1: Nạp đầy khí ammonia vào bình thủy tinh trong suốt, đậy bình bằng nút cao su có ống thủy tinh vuốt nhọn xuyên qua.
Bước 2: Nhúng đầu ống thủy tinh vào một chậu thủy tinh chứa nước có pha thêm dung dịch phenolphthalein.
Cho các phát biểu sau:
| Đúng | Sai | |
|---|---|---|
| a) Ở bước 2, một lát sau nước trong chậu phun vào bình thành những tia có màu hồng. | ||
| b) Phenolphthalein chuyển sang màu hồng, chứng tỏ dung dịch thu được có tính acid. | ||
| c) Khí ammonia tan nhiều trong nước, làm giảm áp suất trong bình và nước bị hút vào bình. | ||
| d) Thí nghiệm này chứng minh, ammonia là một chất có tính khử mạnh. |
Đáp án đúng là: Đ; S; Đ; S
Dựa vào thí nghiệm ở đề bài và tính base của ammonia.
Đáp án cần chọn là: Đ; S; Đ; S
Sự hình thành sulfuric acid trong nước mưa từ sulfur dioxide trong khí quyển như sau:
Trước tiên, sulfur dioxide bị oxi hóa bởi oxygen nhờ chất xúc tác nitrogen monoxide hoặc nitrogen dioxide.
(1) 2SO2(g) + O2(g) $\rightarrow$ 2SO3(g)
Tiếp theo, sulfur trioxide dễ dàng kết hợp với nước mưa để hình thành sulfuric acid.
(2) SO3(g) + H2O(l) $\rightarrow$ H2SO4(aq)
| Đúng | Sai | |
|---|---|---|
| a) Đối với môi trường, sulfur dioxide gây ra hiện tượng mưa acid. | ||
| b) Acid trong nước mưa sẽ làm tăng pH của nước và đất. | ||
| c) Một trong các biện pháp để giảm lượng khí sulfur dioxide phát thải vào khí quyển là thay thế các nhiên liệu hóa thạch bằng nhiên liệu thân thiện môi trường như ethanol, hydrogen...kết hợp khai thác các nguồn năng lượng tái tạo như năng lượng mặt trời, năng lượng gió. | ||
| d) Giả thiết có 495,8 m3 khí SO2 (đo ở đkc) đã phát thải vào khí quyển, trong đó 80% chuyển thành sulfuric acid trong nước mưa. Khi toàn bộ lượng nước mưa này rơi trên vùng đất rộng 50 km2 với lượng mưa trung bình là 20 mm thì nồng độ mol của H2SO4 trong nước mưa là 8.10-6 M. |
Đáp án đúng là: Đ; S; Đ; S
a) Nguyên nhân gây ra mưa acid.
b) Môi trường của dung dịch.
c) Các biện pháp để giảm lượng khí sulfur dioxide.
d) Phân tích dữ liệu đề bài.
Đáp án cần chọn là: Đ; S; Đ; S
Tiến hành thí nghiệm cho một ít chất chỉ thị phenolphthalein vào dung dịch NH3 loãng thu được dung dịch (A). Chia dung dịch (A) vào 3 ống nghiệm.
- Ống nghiệm thứ 1 đun nóng dung dịch một hồi lâu.
- Ống nghiệm thứ 2 thêm dung dịch HCl với số mol HCl bằng số mol NH3 có trong dung dịch (A).
- Ống nghiệm thứ 3 thêm vài giọt dung dịch Na2CO3.
| Đúng | Sai | |
|---|---|---|
| a) Màu hồng của dung dịch ở ống nghiệm 1,2 nhạt dần, sau đó dung dịch trở nên trong suốt. | ||
| b) Dung dịch ở ống nghiệm 3 có màu hồng đậm hơn. | ||
| c) Dung dịch ở ống nghiệm 2,3 mất màu. | ||
| d) Dung dịch ở cả 3 ống nghiệm đều không mất màu. |
Đáp án đúng là: Đ; Đ; S; S
Dựa vào tính chất hóa học của ammonia.
Đáp án cần chọn là: Đ; Đ; S; S
Cho dung dịch các chất sau: HCl, KOH, HF, KCl, NH4Cl, HNO3. Có bao nhiêu chất là chất điện li mạnh?
Đáp án đúng là:
Dựa vào lý thuyết chất điện li mạnh.
Đáp án cần điền là: 5
Ở một nhiệt độ nhất định, phản ứng thuận nghịch N2 (g) + 3H2 (g) ⇌ 2NH3 (g) đạt trạng thái cân bằng khi nồng độ của các chất như sau: [H2] = 2,0 mol/lít, [N2] = 0,01 mol/lít, [NH3] = 0,4 mol/lít. Hằng số cân bằng ở nhiệt độ đó có giá trị là bao nhiêu?
Đáp án đúng là:
Với phản ứng thuận nghịch bất kì: aA +bB$\rightleftharpoons$mM + nN
Khi phản ứng ở trạng thái cân bằng, ta có: $\dfrac{C_{M}^{m}C_{N}^{n}}{C_{A}^{a}C_{B}^{b}} = K_{c}$
Đáp án cần điền là: 2
Cho các tính chất sau của ammonia.
(1) Ammonia tan tốt trong nước.
(2) Ammonia nhẹ hơn không khí.
(3) Dung dịch ammonia có tính base.
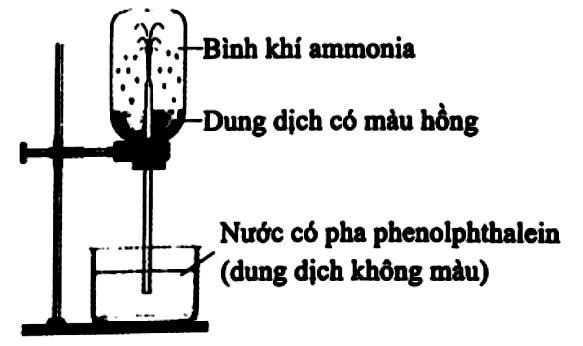
Thí nghiệm như hình dưới đây chứng tỏ tính chất nào của ammonia? Liệt kê các phương án theo số thứ tự giảm dần (321; 21;…)
Đáp án đúng là:
Quan sát thí nghiệm và đưa ra kết luận.
Đáp án cần điền là: 31
Từ 800 tấn quặng pirit sắt (FeS2) chứa 25% tạp chất không cháy, có thể sản xuất được bao nhiêu m3 dung dịch H2SO4 93% (D = 1,83 g/ml)? Giả thiết tỉ lệ hao hụt là 5%.
Đáp án đúng là:
Tính mFeS2= mquặng. 25%.
Tính mH2SO4 = $\dfrac{m_{FeS2}}{120}.98.95\%$
Tính $V_{\text{dd}} = \dfrac{m_{dd}}{D} = \dfrac{m_{ct}.100}{C.D}$
Đáp án cần điền là: 547
Cho dung dịch hỗn hợp X gồm HCl 0,001 M và $\text{CH}_{\text{3}}\text{COOH~0,1M}$. Biết $K_{a,CH_{3}COOH} = 1,75.10^{- 5}$ và bỏ qua sự phân li của nước. pH của dd X là bao nhiêu?
(kết quả làm tròn đến hàng phần mười)
Đáp án đúng là:
Viết phương trình điện li để tính nồng độ H+
Đáp án cần điền là: 2,7
Sau hiện tượng phú dưỡng, một hồ nước có diện tích bề mặt 1 km² và độ sâu trung bình 5 m chứa một lượng lớn xác tảo. Lượng oxygen hòa tan (DO) ban đầu trong hồ là 8 mg/L, nhưng sau quá trình phân hủy xác tảo, nồng độ oxygen giảm xuống còn 2 mg/L. Lượng oxygen (tính bằng kg) đã bị tiêu thụ trong toàn bộ hồ là x tấn. Tính giá trị x?
Đáp án đúng là:
Thể tích của hồ nước = S.độ sâu
⟹ Lượng oxygen giảm
Đáp án cần điền là: 30


