Đề thi thử đại học môn hóa lần 5 năm 2012 trường THPT Chuyên ĐHSP Hà Nội
Thời gian thi : 90 phút - Số câu hỏi : 60 câu - Số lượt thi : 350
Chú ý: Để xem lời giải chi tiết vui lòng chọn "Click vào đề thi"
Một số câu hỏi trong đề thi
Câu 1: Khi điều chế C2H4 từ C2H5OH và H2SO4 đặc ở 1800C thì thu được khí C2H4 có lẫn CO2 và SO2. Nếu cho hỗn hợp khí đi qua các dung dịch: KMnO4, Ca(OH)2, K2CO3, Br2, NaOH thì số dung dịch có thể dùng để loại bỏ CO2 và SO2 đi được là
Câu 2: Một hợp chất X có một số tính chất như: - Dung dịch X làm xanh giấy quỳ tím; - Đốt X trên ngọn lửa đèn khí cho ngọn lửa màu vàng; - Dung dịch X tác dụng được với khí cacbonic; - Dung dịch X có thể tác dụng với dung dịch AlCl3 giải phóng khí Phân tử khối của X (g/mol) là
Câu 3: Đốt cháy hoàn toàn m gam hỗn hợp X gồm 2 hiđrocacbon mạch hở, thuộc cùng dãy đồng đẳng rồi hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2 dư tạo ra 14 gam kết tủa, dung dịch sau phản ứng có khối lượng giảm 6,22 gam so với khối lượng dung dịch Ca(OH)2 ban đầu. Mặt khác cho m gam hỗn hợp X vào bình đựng dung dịch AgNO3/NH3 dư thu được 10,42 gam kết tủa. Biết tỉ khối hơi của X so với H2 nhỏ hơn 20. Thành phần % khối lượng của hiđrocacbon có công thức phân tử khối lớn hơn trong X là
Câu 4: Cho 4,48 gam hỗn hợp gồm CH3COOC2H5 và CH3COOC6H5 (có tỉ lệ mol 1 : 1) tác dụng với 800ml dung dịch NaOH 0,1M thu được dung dịch X. Cô cạn dung dịch X thì khối lượng chất rắn thu được là
Câu 5: X, Y, Z là 3 kim loại trong sơ đồ phản ứng sau:
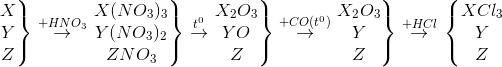 X, Y, Z lần lượt là
X, Y, Z lần lượt là
Câu 6: Cho các phản ứng sau:
(1) Fe(OH)2 + H2SO4 đặc 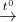
(2) Fe + H2SO4 loãng →
(3) Fe(OH)3 + H2SO4 đặc 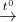
(4) Fe3O4 + H2SO4 loãng →
(5) Cu + + H2SO4 loãng + dung dịch NaNO3 →
(6) FeCO3 + H2SO4 đặc 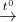
Số phản ứng hóa học trong đó H2SO4 đóng vai trò là chất oxi hóa là
Câu 7: Hòa tan hoàn toàn Fe3O4 trong H2SO4 loãng dư thu được dung dịch X. Cho dung dịch X lần lượt phản ứng với các chất: Cu, Ag, dung dịch KMnO4, Na2CO3, AgNO3, KNO3. Số trường hợp có phản ứng xảy ra với dung dịch X là
Câu 8: Nhiệt phân hoàn toàn hỗn hợp rắn gồm KNO3, Cu(NO3)2, Fe(NO3)2 và AgNO3, sau phản ứng thu được hỗn hợp sản phầm rắn gồm:
Câu 9: X là axit hữu cơ mạch hở có chứa 2 liên kết π trong phân tử. X tác dụng với NaHCO3 dư thu được số mol CO2 bằng số mol của X phản ứng. Công thức tổng quát của X là
Câu 10: Loại phân bón hóa học có tác dụng kích thích cây cối sinh trưởng, ra nhiều lá, nhiều hoa và phù hợp với các loại đất phèn là
Câu 11: Cho dãy các chất: (NH2)2CO; NH4Cl; (NH4)2SO4; NaHCO3; ZnCl2; FeCl2; KCl. Số chất trong dãy tác dụng với dung dịch Ba(OH)2 dư tạo thành kết tủa sau khi các phản ứng xảy ra hoàn toàn là
Câu 12: Cho các polime sau đây: (1) tơ tằm; (2) sợi bông; (3) sợi đay; (4) tơ enang; (5) tơ visco; (6) nilon 6 - 6; (7) tơ axetat. Số loại polime có nguồn gốc xenlulozơ là
Câu 13: Cho các chất sau: Al; Al(OH)3; CrO3; ZnO; NaHCO3; H2NCH2COOCH3; HOOCCH2CH2CH(NH2)COOH, CuSO4; NaHSO4. Theo Bronsted, số chất lưỡng tính là
Câu 14: Dung dịch chứa muối X không làm quỳ tím hóa đỏ; dung dịch chứa muối Y làm quỳ tím hóa đỏ. Trộn hai dung dịch muối này với nhau thì vừa có kết tủa vừa có khí bay ra. X và Y lần lượt là hai dung dịch muối nào dưới đây?
Câu 15: Cho các chất: C6H5NH3Cl, (phenylamoni clorua), C6H5Cl (phenyl clorua), C2H5Cl, NaHCO3, CO, CO2, Zn(OH)2, Mg(OH)2, HF, Cl2, NH4Cl. Số chất tác dụng được với dung dịch NaOH loãng, đun nóng là
Câu 16: Cho các chất sau: C2H3Cl, C2H4, C2H6, C2H3COOH, C6H11NO (caprolactam), vinyl axetat, phenyl axetat. Số các chất trong dãy có khả năng tham gia phản ứng trùng hợp là
Câu 17: Cho 14 gam bột Fe vào 400ml dung dịch X gồm: AgNO3 0,5M và Cu(NO3)2 xM. Khuấy nhẹ cho tới khi phản ứng kết thúc thu được 30,4 gam chất rắn Y và dung dịch Z. Cho Z tác dụng với dung dịch NaOH dư thì thu được kết tủa một hiđroxit kim loại. Giá trị của X là
Câu 18: Người ta dự kiến điều chế oxi theo các quá trình dưới đây:
1) Điện phân H2O
2) Phân hủy H2O2 với chất xúc tác MnO2
3) Điện phân dung dịch CuSO4
4) Chưng cất phân đoạn không khí lỏng
5) Điện phân dung dịch NaOH
6) Nhiệt phân KClO3 với xúc tác MnO2
Số quá trình thường áp dụng để diều chế O2 trong phòng thí nghiệm là
Câu 19: Đun nóng 34,2 gam mantozơ trong dung dịch axit sunfuric loãng, đun nóng. Trung hòa dung dịch thu được sau phản ứng bằng dung dịch NaOH rồi cho tác dụng hoàn toàn với dung dịch AgNO3/NH3 dư đun nóng thu được 37,8 gam Ag. Hiệu suất phản ứng thủy phân mantozơ là
Câu 20: Cho cân bằng hóa học sau: CaCO3 (r) 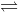 CaO (r) + CO2 (k) ΔH > 0 Trong các yếu tố:
CaO (r) + CO2 (k) ΔH > 0 Trong các yếu tố:
(1) tăng nhiệt độ;
(2) thêm một lượng CaCO3;
(3) lấy bớt CO2 ra;
(4) tăng áp suất chung của hệ.
Số yếu tố làm thay đổi cân bằng của hệ là
Câu 21: Dãy gồm các chất trong phân tử chỉ chứa một loại liên kết là
Câu 22: Cho 13,92 gam Fe3O4 tác dụng hoàn toàn với dung dịch HNO3, sau phản ứng thu được dung dịch X và 0,448 lít khí NxOy (sản phẩm khử duy nhất ở đktc). Khối lượng HNO3 nguyên chất đã tham gia phản ứng là
Câu 23: Cho 12,55 gam muối CH3CH(NH3Cl)COOH tác dụng với 150ml dung dịch Ba(OH)2 1M. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Giá trị của m là
Câu 24: Cho m gam hỗn hợp Y gồm axit axetic, phenol, ancol etylic tác dụng vừa đủ với Na thu được 19,6 gam hỗn hợp muối X. Đốt cháy hoàn toàn X thu được 10,6 gam muối cacbonat. Nếu cho 30,4 gam hỗn hợp Y trên tác dụng với Na dư thì thu được V lít H2 (đktc). Giá trị của V là
Câu 25: CHo hỗn hợp X gồm Zn, Fe vào dung dịch chứa AgNO3 và Cu(NO3)2, sau phản ứng thu được hỗn hợp Y gồm 2 kim loại và dung dịch Z. Cho NaOH dư vào dung dịch Z thu được kết tủa gồm hai hiđroxit kim loại. Dung dịch Z chứa
Câu 26: X là một anđehit mạch hở. Để tác dụng hoàn toàn với V lít hơi X cần tối đa 3V lít H2 (Ni, t0) thu được chất hữu cơ Y. Cho toàn bộ Y tác dụng với Na dư thu được V lít H2. Mặt khác đốt cháy hoàn toàn m gam X thu được 44 gam CO2 và 9 gam H2O. Biết các phản ứng xảy ra hoàn toàn, các thể tích khí đo ở cùng điều kiện. Công thức của X và giá trị của m lần lượt là
Câu 27: X, Y, Z là các hợp chất vô cơ của một kim loại, khi đốt nóng ở nhiệt độ cao đều cho ngọn lửa màu vàng, biết: X + Y → Z (1) Y 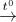 Z + H2O + E↑ (2) E + X → Y (3) E + X → Z (4) Biết E là hợp chất của cacbon. X, Y, Z, E lần lượt là:
Z + H2O + E↑ (2) E + X → Y (3) E + X → Z (4) Biết E là hợp chất của cacbon. X, Y, Z, E lần lượt là:
Câu 28: Hỗn hợp gồm hiđrocacbon X và oxi có tỉ lệ số mol tương ứng là 1 : 10. Đốt cháy hoàn toàn hỗn hợp trên thu được hỗn hợp khí Y. Cho Y qua dung dịch H2SO4 đặc thu được hỗn hợp khí Z có tỉ khối đối với hiđro bằng 19. Số đồng phân cấu tạo của X có khả năng làm mất màu dung dịch brom là
Câu 29: Cho 2,76 gam chất hữu cơ X gồm C, H, O tác dụng với dung dịch NaOH vừa đủ sau đó chưng khô thì phần bay hơi chỉ có nước và còn lại 2 muối của Na có khối lượng 4,44 gam. Nung nóng 2 muối này trong oxi dư, phản ứng hoàn toàn thu được 2,464 lít CO2 (đktc), 3,18 gam Na2CO3 và 0,9 gam H2O. Biết công thức phân tử của X trùng với công thức đơn giản nhất. X là
Câu 30: Trộn 21,6 gam bột Al với m gam hỗn hợp X (gồm FeO, Fe2O3, và Fe3O4) được hỗn hợp Y. Nung Y ở nhiệt độ cao trong điều kiện không có không khí đến phản ứng hoàn toàn thu được hỗn hợp rắn Z. Cho Z tác dụng với dung dịch NaOH dư thu được 6,72 lít khí. Nếu cho Z tác dụng với dung dịch HNO3 loãng dư thì thu được 19,04 lít NO (sản phẩm khử duy nhất). Biết các thể tích khí đo ở đktc. Giá trị của m là
Câu 31: Cho 7,8 gam kali tác dụng với 1 lít dung dịch HCl 0,1M, sau phản ứng thu được dung dịch X và V lít H2 (đktc). Cô cạn dung dịch X thu được m gam chất rắn khan. Giá trị của V và m lần lượt là
Câu 32: Cho các thuốc thử sau: (1) dung dịch Ca(OH)2; (2) dung dịch Br2; (3) dung dịch KMnO4; (4) dung dịch H2S; (5) dung dịch NaOH; (6) giấy quỳ tím ẩm. Số thuốc thử có thể dùng để phân biệt 2 khí CO2 và SO2 là
Câu 33: Hấp thụ hoàn toàn V lít CO2 (ở đktc) vào bình đựng 200ml dung dịch X (NaOH 1M và Na2CO3 0,5M). Kết tinh dung dịch thu được sau phản ứng (chỉ làm bay hơi nước) thì thu được 19,9 gam chất rắn khan. Giá trị V là
Câu 34: Đốt cháy hoàn toàn m gam hỗn hợp Z gồm hai axit cacboxylic X và Y kế tiếp nhau trong dãy đồng đẳng (MX > My) cần tối thiểu 14,748 lít O2 (đktc). Sản phẩm cháy cho hấp thụ hết vào bình đựng dung dịch Ca(OH)2 dư thu được 60 gam kết tủa và khối lượng dung dịch thu được sau phản ứng giảm 22,8 gam so với dung dịch Ca(OH)2 ban đầu. Thành phần % khối lượng của X có trong Z là
Câu 35: Cho các dung dịch: Fe(NO3)3 + AgNO3, FeCl3, CuCl2, HCl, CuCl2 + HCl, ZnCl2. Nhúng vào mỗi dung dịch một thanh Fe. Số trường hợp có thể xảy ra ăn mòn điện hóa là
Câu 36: Hợp chất thơm X có phần trăm khối lượng các nguyên tố: 67,742% C; 6,451% H, còn lại là oxi. Tỉ khối hơi của X đối với H2 nhỏ hơn 100. Cho 18,6 gam X phản ứng hết với dung dịch chứa 0,15 mol NaOH. Số công thức cấu tạo phù hợp với X là
Câu 37: Hòa tan hoàn toàn hỗn hợp X gồm Mg, Zn trong bình đựng a mol HNO3 thu được hỗn hợp khí Y (gồm b mol NO và c mol N2O) và dung dịch Z (không chứa muối amoni). Thêm V lít dung dịch NaOH 1M vào dung dịch Z thì thu được lượng kết tủa lớn nhất. Biểu thức liên hệ giữa V với a, b và c là
Câu 38: Cho 13,6 hỗn hợp bột X (gồm Fe và Mg) vào 200ml dung dịch CuSO4 1M. Sau khi phản ứng kết thúc thu được chất rắn Y và dung dịch Z. Cho chất rắn Y tác dụng với dung dịch HCl (dư) thu được 2,24 lít H2 (ở đktc). Cho NaOH dư vào dung dịch Z thu được kết tủa hai hiđroxit kim loại. % khối lượng của Fe có trong X là
Câu 39: Hấp thụ hoàn toàn 10,8 gam hỗn hợp (gồm CO2 và SO2) có tỉ khối hơi so với H2 bằng 27 vào 2 lít dung dịch Ba(OH)2 0,075M được kết tủa và dung dịch Y. Khối lượng dung dịch Y so với khối lượng dung dịch Ba(OH)2 ban đầu
Câu 40: Có bao nhiêu nguyên tố hóa học mà nguyên tử có số thứ tự ≤ 20 có 2 electron độc thân ở lớp ngoài cùng?
Câu 41: Cho 4,06 gam anđehit X, mạch hở tác dụng với lượng dư dung dịch AgNO3/NH3. Toàn bộ lượng Ag thu được cho tác dụng hết với dung dịch HNO3 đặc, nóng, dư thu được 3,248 lít khí (đktc). Mặt khác cho 4,06 gam X tác dụng với H2 dư (Ni, t0) thu được m gam chất hữu cơ Y (Biết các phản ứng xảy ra hoàn toàn, tỉ khối hơi của X so với N2 nhỏ hơn 4). Giá trị của m là
Câu 42: Cho 0,46 gam Na vào 20 gam dung dịch giấm ăn ( chứa 4,2% CH3COOH). Sau khi kết thúc phản ứng, đem cô cạn dung dịch thu được m gam chất rắn. Giá trị của m là
Câu 43: Cho Cu vào dung dịch FeCl3; H2S vào dung dịch CuSO4; HI vào dung dịch FeCl3; dung dịch AgNO3 vào dung dịch Fe(NO3)3; dung dịch HCl vào dung dịch Fe(NO3)2. Số cặp chất phản ứng với nhau là
Câu 44: Cho các dung dịch có cùng nồng độ: CH2COONa (1); H2SO4 (2); HCl (3); NaNO3 (4). Giá trị pH của các dung dịch trên được sắp xếp theo chiều tăng từ trái sang phải là:
Câu 45: Hòa tan hoàn toàn m gam hỗn hợp gồm FeS2 và Cu2S vào dung dịch axit HNO3 sau phản ứng thu được dung dịch X (chỉ chứa hai chất tan) với tổng khối lượng là 43,2 gam. Giá trị của m là
Câu 46: Đốt cháy hoàn toàn một ancol X thì số mol CO2 thu được bằng 75% số mol H2O tạo thành; tổng số mol CO2 và H2O bằng 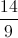 lần tổng số mol X và O2 đã phản ứng. Cho 6,9 gam X tác dụng với Na dư thì thu được V lít H2 (đktc). Giá trị của V là
lần tổng số mol X và O2 đã phản ứng. Cho 6,9 gam X tác dụng với Na dư thì thu được V lít H2 (đktc). Giá trị của V là
Câu 47: Đun nóng dung dịch chứa 18 gam hỗn hợp glucozơ và fructozơ với lượng dư Cu(OH)2 trong môi trường kiềm tới khi phản ứng hoàn toàn thu được m gam kết tủa Cu2O. Giá trị của m
Câu 48: Cho các dung dịch: HCl, FeCl3, H2SO4, NaHSO4, CH3COOH, Na2CO3, HNO2. Số lượng dung dịch tác dụng được với dung dịch đemimetylamin là
Câu 49: Nhiệt phân hoàn toàn hỗn hợp gồm Cu(NO3)2 + AgNO3 thu được hỗn hợp khí có tỉ khối so với H2 bằng 21,25. Phần trăm khối lượng của Cu(NO3)2 trong hỗn hợp là
Câu 50: Tác nhân chủ yếu gây mưa axit là
Câu 51: Cho 50ml dung dịch X chứa 3,51 gam hỗn hợp saccarozơ và glucozơ phản ứng với lượng dư AgNO3 trong dung dịch NH3, thu được 2,16 gam Ag. Đun nóng 100ml dung dịch X với 100ml dung dịch H2SO4 0,05M cho đến khi phản ứng xảy ra hoàn toàn thu được dung dịch Y, giả thiết thể tích dung dịch không thay đổi. Nồng độ mol của glucozơ có trong dung dịch Y là
Câu 52: X, Y là 2 anđehit no có cùng số nguyên tử C trong phân tử. Đốt cháy hoàn toàn 13 gam hỗn hợp (X, Y) thu được 0,6 mol CO2 và 0,5 mol H2O. Xác định X, Y và tính % khối lượng của mỗi chất trong hỗn hợp
Câu 53: Xét cân bằng hóa học của một số phản ứng sau:
1) Fe2O3 (r) + 3CO (k) 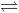 2Fe (r) + 3CO2 (k)
2) CaO (r) + CO2 (k)
2Fe (r) + 3CO2 (k)
2) CaO (r) + CO2 (k) 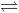 CaCO3 (r)
3) N2O4 (k)
CaCO3 (r)
3) N2O4 (k) 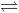 2NO2 (k)
4) H2 (k) + I2 (k)
2NO2 (k)
4) H2 (k) + I2 (k) 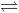 2HI (k)
5) 2SO2 (k) + O2 (k)
2HI (k)
5) 2SO2 (k) + O2 (k) 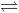 2SO3 (k)
Khi tăng áo suất, cân bằng hóa học bị chuyển dịch ở các hệ:
2SO3 (k)
Khi tăng áo suất, cân bằng hóa học bị chuyển dịch ở các hệ:
Câu 54: Đem nung 66,2 gam Pb(NO3)2 một thời gian thu được 53,24 gam chất rắn và V lít khí (ở đktc). Giá trị của V và hiệu suất phản ứng nhiệt phân lần lượt là
Câu 55: Hiện tượng nào sau đây đã được mô tả không đúng?
Câu 56: Để đánh giá sự ô nhiễm kim loại nặng trong nước thải của một nhà máy, người ta lấy một ít nước, cô đặc rồi thêm dung dịch Na2S vào thấy xuất hiện kết tủa màu vàng. Hiện tượng trên chứng tỏ nước thải bị ô nhiễm bởi ion
Câu 57: Hóa hơi 31,04 gam hỗn hợp gồm một axit no, đơn chức X và một axit no, đa chức Y (Y có mạch cacbon không phân nhánh) và số mol của X lớn hơn của Y, thu được một thể tích hơi bằng thể tích của 11,2 gam N2 ( đo trong cùng điều kiện nhiệt độ áp suất). Nếu đốt cháy toàn bộ hỗn hợp hai axit trên thì thu được 42,24 gam CO2. Thành phần phần trăm khối lượng của X trong hỗn hợp ban đầu bằng
Câu 58: Khi thủy phân hoàn toàn 0,1 mol peptit X mạch hở ( X tạo bởi từ các amino axit có một nhóm amino và một nhóm cacboxylic) bằng lượng dung dịch NaOH gấp đôi lượng cần phản ứng, cô cạn dung dịch thu được hỗn hợp chất rắn tăng so với khối lượng X là 78,2 gam. Số liên kết peptit trong X là
Câu 59: Cho biết 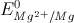 = - 2,37V;
= - 2,37V; 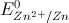 = - 0,76V;
= - 0,76V;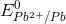 = -0,13V. Pin điện hóa có suất điện động chuẩn bằng 0,63V được cấu tạo bởi hai cặp oxi hóa - khử
= -0,13V. Pin điện hóa có suất điện động chuẩn bằng 0,63V được cấu tạo bởi hai cặp oxi hóa - khử
Câu 60: Hỗn hợp X gồm 2 ancol có cùng số nguyên tử cacbon. Cho 0,30 mol hỗn hợp X tác dụng với Na (dư) thu được 4,48 lít khí H2 (đktc). Mặt khác đốt cháy 0,15 mol hỗn hợp X thu được 13,44 lít khí CO2 (ở 00C và 0,50 atm). Thành phần % khối lượng của ancol có khối lượng ít hơn trong hỗn hợp là
Bạn có đủ giỏi để vượt qua
| Xếp hạng | Thành viên | Đúng | Làm | Đạt | Phút |
| 1 |
|
50 | 50 | 100% | 2.18 |
| 2 |
|
47 | 50 | 94% | 6.3 |
| 3 |
|
43 | 50 | 86% | 58.47 |
| 4 |
|
40 | 49 | 82% | 89.33 |
| 5 |
|
40 | 50 | 80% | 67.45 |
| 6 |
|
40 | 50 | 80% | 90.05 |
| 7 |
|
38 | 50 | 76% | 78.22 |
| 8 |
|
38 | 50 | 76% | 90.67 |
| 9 |
|
37 | 50 | 74% | 36.67 |
| 10 |
|
36 | 50 | 72% | 3.28 |
| 11 |
|
33 | 46 | 72% | 71.93 |
| 12 |
|
34 | 50 | 68% | 76.18 |
| 13 |
|
30 | 39 | 77% | 90.08 |
| 14 |
|
30 | 41 | 73% | 68.47 |
| 15 |
|
29 | 40 | 73% | 55.32 |
| 16 |
|
26 | 33 | 79% | 77.35 |
| 17 |
|
28 | 50 | 56% | 68.18 |
| 18 |
|
25 | 42 | 60% | 83.33 |
| 19 |
|
19 | 25 | 76% | 38.93 |
| 20 |
|
27 | 50 | 54% | 89.52 |
| 21 |
|
18 | 24 | 75% | 28.22 |
| 22 |
|
26 | 49 | 53% | 66.87 |
| 23 |
|
26 | 50 | 52% | 85.37 |
| 24 |
|
25 | 50 | 50% | 82.62 |
| 25 |
|
24 | 50 | 48% | 71.33 |
| 26 |
|
16 | 28 | 57% | 39.63 |
| 27 |
|
13 | 22 | 59% | 148.25 |
| 28 |
|
13 | 22 | 59% | 16.97 |
| 29 |
|
13 | 25 | 52% | 29.5 |
| 30 |
|
20 | 49 | 41% | 57.02 |
| 31 |
|
5 | 6 | 83% | 3.02 |
| 32 |
|
7 | 13 | 54% | 25.25 |
| 33 |
|
6 | 11 | 55% | 10.78 |
| 34 |
|
5 | 13 | 38% | 16.55 |
| 35 |
|
3 | 7 | 43% | 11.7 |
| 36 |
|
4 | 11 | 36% | 2.55 |
| 37 |
|
5 | 14 | 36% | 13.75 |
| 38 |
|
0 | 0 | 0% | 1.88 |
| 39 |
|
0 | 0 | 0% | 90.12 |
| 40 |
|
4 | 15 | 27% | 15.88 |
| 41 |
|
10 | 33 | 30% | 77.12 |
| 42 |
|
1 | 10 | 10% | 0.3 |