Hoàn thành các yêu cầu sau:
Hoàn thành các yêu cầu sau:
Trả lời cho các câu 1, 2 dưới đây:
Dựa vào tính chất hóa học của các chất.
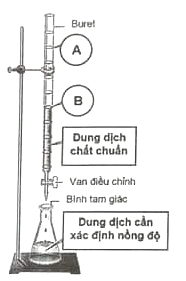 - Buret: là dụng cụ dùng để lấy chính xác một thể tích dungdịch, trên thân buret có chia vạch xác định thể tích (ở đây, sửdụng buret có vạch chia độ chính xác đến 0,1 ml). - Dung dịch chất chuẩn: là dung dịch đã biết chính xác nồng độ. - Bình tam giác: dùng để dựng dung dịch chất cần xác định nồng độ và các chất chỉ thị cần thiết. - Vạch A trên buret: mức thể tích dung dịch chất chuẩn lúc bắt đầu tiến hành chuẩn độ. - Vạch B trên buret: mức thể tích dung dịch chất chuẩn còn lại ngay tại thời điểm dừng chuẩn độ. - Tại thời điểm dừng chuẩn độ, có thể xem như lượng chất chuẩn vừa đủ để phản ứng với dung dịch chất cần chuẩn độ. Lưu ý: để tăng tính chính xác trong phép chuẩn độ, cần lặp lại nhiều lần với cùng điều kiện, kết quả cuối cùng lấy giá trị trung bình của các lần thực hiện. Hai học sinh G và H tiến hành chuẩn độ mẫu dung dịch H2SO4, nồng độ aM bằng chất chuẩn là dung dịch NaOH 0,05M với cùng quy trình sau: - Chuyển dung dịch chất chuẩn lên buret. - Lấy chính xác 10 ml mẫu cần phân tích, thêm nước cất để pha thành 100 ml dung dịch P. - Tiếp tục lấy chính xác 10 ml dung dịch P cho vào bình tam giác dung tích 250 ml, cho thêm nước cất và 3 giọt chất chỉ thị. - Nhỏ từ từ dung dịch chuẩn từ buret vào bình tam giác đến khi chất chỉ thị đổi màu (bền trong 30 giây) thì dừng lại. Sau khi thực hiện chuẩn độ lặp lại 3 lần liên tiếp, thu được kết quả thí nghiệm như sau:
- Buret: là dụng cụ dùng để lấy chính xác một thể tích dungdịch, trên thân buret có chia vạch xác định thể tích (ở đây, sửdụng buret có vạch chia độ chính xác đến 0,1 ml). - Dung dịch chất chuẩn: là dung dịch đã biết chính xác nồng độ. - Bình tam giác: dùng để dựng dung dịch chất cần xác định nồng độ và các chất chỉ thị cần thiết. - Vạch A trên buret: mức thể tích dung dịch chất chuẩn lúc bắt đầu tiến hành chuẩn độ. - Vạch B trên buret: mức thể tích dung dịch chất chuẩn còn lại ngay tại thời điểm dừng chuẩn độ. - Tại thời điểm dừng chuẩn độ, có thể xem như lượng chất chuẩn vừa đủ để phản ứng với dung dịch chất cần chuẩn độ. Lưu ý: để tăng tính chính xác trong phép chuẩn độ, cần lặp lại nhiều lần với cùng điều kiện, kết quả cuối cùng lấy giá trị trung bình của các lần thực hiện. Hai học sinh G và H tiến hành chuẩn độ mẫu dung dịch H2SO4, nồng độ aM bằng chất chuẩn là dung dịch NaOH 0,05M với cùng quy trình sau: - Chuyển dung dịch chất chuẩn lên buret. - Lấy chính xác 10 ml mẫu cần phân tích, thêm nước cất để pha thành 100 ml dung dịch P. - Tiếp tục lấy chính xác 10 ml dung dịch P cho vào bình tam giác dung tích 250 ml, cho thêm nước cất và 3 giọt chất chỉ thị. - Nhỏ từ từ dung dịch chuẩn từ buret vào bình tam giác đến khi chất chỉ thị đổi màu (bền trong 30 giây) thì dừng lại. Sau khi thực hiện chuẩn độ lặp lại 3 lần liên tiếp, thu được kết quả thí nghiệm như sau: 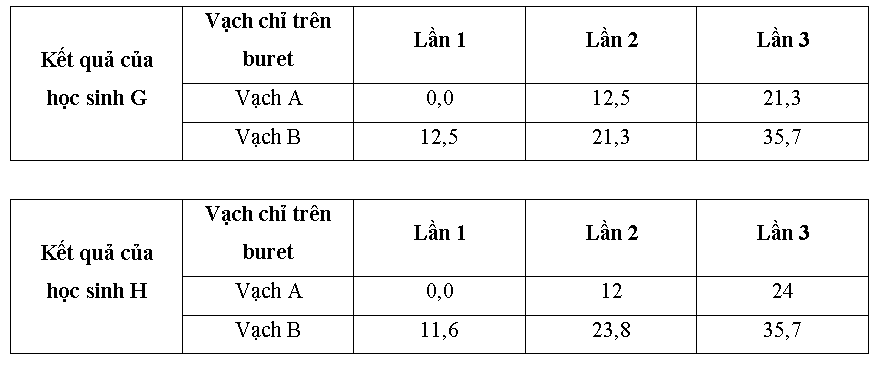 a) Trong phép chuẩn độ này, chất chỉ thị được sử dụng là phenolphtalein thì màu của dung dịch trong bình tam giác tại thời điểm dừng chuẩn độ thay đổi như thế nào? b) Dựa vào dữ kiện, hãy nhận xét số liệu thu được từ học sinh nào có khả năng mang lại kết quả phân tích chính xác hơn? Giải thích ngắn gọn. c) Xác định nồng độ dung dịch H2SO4 trong mẫu theo kết quả của phép chuẩn độ trên.
a) Trong phép chuẩn độ này, chất chỉ thị được sử dụng là phenolphtalein thì màu của dung dịch trong bình tam giác tại thời điểm dừng chuẩn độ thay đổi như thế nào? b) Dựa vào dữ kiện, hãy nhận xét số liệu thu được từ học sinh nào có khả năng mang lại kết quả phân tích chính xác hơn? Giải thích ngắn gọn. c) Xác định nồng độ dung dịch H2SO4 trong mẫu theo kết quả của phép chuẩn độ trên. Dựa vào phương pháp chuẩn độ axit – bazơ.
Quảng cáo
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











