Khi t-butyl chloride [(CH3)3CCl] hòa tan vào dung dịch acetone – H2O, chất này phản
Khi t-butyl chloride [(CH3)3CCl] hòa tan vào dung dịch acetone – H2O, chất này phản ứng với H2O hoàn toàn để tạo thành t-butyl alcohol [(CH3)3COH] theo phản ứng:
${(C{H_3})_3}CCl + {H_2}O\xrightarrow{{acetone}}{(C{H_3})_3}COH + {H^ + } + C{l^ - }$
Acetone kém phân cực hơn H2O. Chính vì vậy, khi nồng độ acetone tăng dần dung dịch acctone – H2O sẽ giàm dần tính phân cực.
Hình 1 và 2 biểu diễn độ dẫn điện của 5 dung dịch acetone – H2O theo thời gian sau khi thêm 1 mg (CH3)3CCl vào 100 mL mỗi dung dịch. Độ dẫn điện (tăng khi nồng độ ion trong dung dịch tăng) ngừng tại khi phàn ứng kết thúc (điềm kết thúc được kí hiệu "KT")
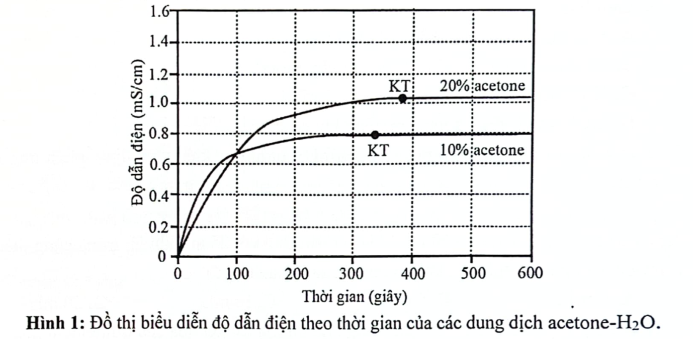

Lưu ý: Trong Hình 1 và 2, nồng độ acetone đã cho là nồng độ phần trăm về khối lượng, đơn vị đo độ dẫn điện là milisiemen trên cetimet, mS/cm
Trả lời cho các câu 1, 2, 3, 4, 5, 6 dưới đây:
Phản ứng giữa t-butyl chloride và nước trong môi trường acetone tạo ra sản phẩm nào?
Đáp án đúng là: A
Dựa vào thông tin bài đọc, phương trình phản ứng nêu sản phẩm
Sơ đồ phản ứng: Chất tham gia ⟶ Sản phẩm
Đáp án cần chọn là: A
Tại sao độ dẫn điện của dung dịch acetone-H₂O tăng lên theo thời gian trong thí nghiệm này?
Đáp án đúng là: A
Độ dẫn điện của dung dịch phụ thuộc vào nồng độ các ion mang điện.
Nồng độ ion mang điện càng cao, độ dẫn điện của dung dịch càng lớn.
Đáp án cần chọn là: A
Dựa vào biểu đồ ở Hình 1, nồng độ acetone nào cho phản ứng diễn ra nhanh nhất?
Đáp án đúng là: A
Tốc độ phản ứng càng nhanh, thời gian phản ứng càng ngắn.
Đáp án cần chọn là: A
Tại sao khi nồng độ acetone trong dung dịch tăng, thời gian đạt đến điểm kết thúc "KT" của phản ứng lại kéo dài?
Đáp án đúng là: A
Mối quan hệ giữa acetone và độ dẫn điện của dung dịch.
Đáp án cần chọn là: A
Dựa vào quy luật phản ứng và tính chất dung môi, hãy dự đoán điều gì xảy ra nếu nồng độ acetone trong dung dịch giảm xuống dưới 10%?
Đáp án đúng là: C
Mối quan hệ giữa tính phân cực của dung dịch tới thời gian phản ứng:
Tính phân cực của dung dịch càng giảm thời gian phản ứng càng ít, tốc độ phản ứng càng cao.
Đáp án cần chọn là: C
Nếu tiếp tục tăng nồng độ acetone lên trên 50%, phản ứng sẽ diễn ra như thế nào?
Đáp án đúng là: B
Mối quan hệ giữa tính phân cực của dung dịch tới thời gian phản ứng:
Tính phân cực của dung dịch càng giảm thời gian phản ứng càng ít, tốc độ phản ứng càng cao.
Đáp án cần chọn là: B
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











