Kim loại
Hòa tan hết m gam hỗn hợp ba oxit của sắt vào dung dịch HCl thu được dung dịch X. Cô cạn dung dịch X thu được m1 gam hỗn hợp 2 muối ( có tỷ lệ mol 1:1). Mặt khác, nếu sục thật chậm khí clo đến dư vào dung dịch X, khi phản ứng kết thúc đem cô cạn dung dịch thì thu được (m1 + 1,42) gam muối khan. Hãy tính giá trị của m.
Đáp án đúng là: D
Quảng cáo
Đáp án cần chọn là: D
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com




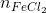 = số mol phản ứng với FeCl2 =
= số mol phản ứng với FeCl2 = 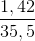 = 0,04 (mol)
= 0,04 (mol) số mol Cl = 0,1 (mol)
số mol Cl = 0,1 (mol)







