(a) Hòa tan hoàn toàn m (gam) hỗn hợp gồm Al và Mg trong V (ml) dung dịch HNO3 2M. Kết thúc phản
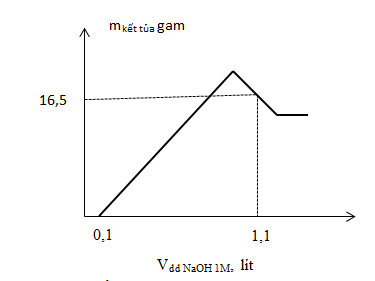
(a) Hòa tan hoàn toàn m (gam) hỗn hợp gồm Al và Mg trong V (ml) dung dịch HNO3 2M. Kết thúc phản ứng, thu được dung dịch E (không chứa muối amoni) và 0,1 mol hỗn hợp khí gồm N2 và N2O có tỉ khối so với oxi là 1,125. Cho từ từ dung dịch NaOH 1M vào dung dịch E thì lượng kết tủa biến thiên theo đồ thị bên. Xác định các giá trị của m và V.
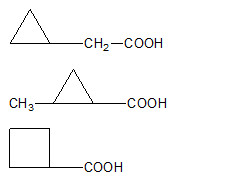
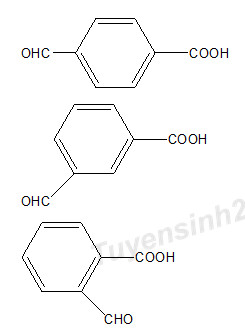
(b) Hợp chất hữu cơ X ( chứa C, H, O) có khối lượng mol nhỏ hơn 200 gam/mol, trong đó oxi chiếm 32% khối lượng X. Khi cho X vào dung dịch NaHCO3 thấy có khí bay ra, X không làm mất màu dung dịch KMnO4/KOH loãng lạnh. Viết công thức cấu tạo các chất X thỏa mãn.
Quảng cáo
a)
Gọi số mol Al và Mg lần lượt là x và y (mol)
Viết quá trình nhường, nhận e
Dùng phương pháp bảo toàn electron: ne(KL nhường) = ne( N+5 nhận) (1)
Quan sát đồ thị: tại giá trị V= 0,1 lít bắt đầu đường đồ thị đi lên => đây là lượng NaOH dùng để trung hòa HNO3 dư => nHNO3 dư = ?
Tại V = 1,1 lít thì đồ thị đạt cực đại, sau đó lại đi xuống => Al(OH)3 bị hòa tan 1 phần
Gọi số mol của Al(OH)3 còn lại là z (mol)
Áp dụng công thức: nNaOH = nHNO3 dư + 2nMg2+ + 4nAl(OH)3 – nAl(OH)3 còn lại = 1,1 (2)
m↓ = mMg(OH)2 + mAl(OH)3 còn lại = 16,5 (3)
Từ (1), (2), (3) => x, y, z = ?
=> m = mAl + mMg = 27x+ 24y = ? (g)
nHNO3 = nHNO3 dư + 2nN2 + 2nN2O + 3nAl(NO3)3 + 2nMg(NO3)2 = ?
b)
Gọi công thức chung của x là CxHyOz
Hợp chất hữu cơ X có MX < 200 => mO < 200.32/100 => mO < 64 => z < 4
Mà X phản ứng với NaHCO3 sinh ra khí nên X là axit
=> 2 ≤ z < 4
\(\begin{gathered}
+ {\text{ }}z = 2:{M_X} = {m_O}.\frac{{100}}{{32}} = 32.\frac{{100}}{{32}} = 100 \hfill \\
\to 12x + y + 32 = 100 \to 12x + y = 68 \to y = 68 - 12x \hfill \\
\end{gathered} \)
Mà 0 < H ≤ 2C + 2 => 0 < y ≤ 2x + 2 => 0 < 68 – 12x ≤ 2x + 2 => 4,7 ≤ x < 5,67 => x = 5
CTPT của X là C5H8O2 => CTCT thỏa mãn
\(\begin{gathered}
+ {\text{ }}z = 3:{M_X} = {m_O}.\frac{{100}}{{32}} = 48.\frac{{100}}{{32}} = 150 \hfill \\
\to 12x + y + 48 = 150 \to 12x + y = 102 \to y = 102 - 12x \hfill \\
\end{gathered} \)
Mà 0 < H ≤ 2C + 2 => 0 < y ≤ 2x + 2 => 0 < 102 – 12x ≤ 2x + 2 => 7,14 ≤ x < 8,5 => x = 8
CTPT của X là C8H6O3 => CTCT thỏa mãn là:
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com