Phi kim
Hòa tan hoàn toàn 5,94 gam Al vào dung dịch NaOH dư được khí thứ nhất. Cho 1,896 gam KMnO4 tác dụng hết với axit HCl đặc, dư thu được khí thứ hai. Nhiệt phân hoàn toàn 12,25 gam KClO3 có xúc tác, thu được khí thứ ba. Cho toàn bộ 3 khí điều chế ở trên vào một bình kín rồi đốt cháy để phản ứng xảy ra hoàn toàn. Sau đó làm lạnh bình để cho hơi nước ngưng tụ hết và giả thiết các chất tan hết vào nước thu được dung dịch E.
Trả lời cho các câu 1, 2 dưới đây:
Đáp án đúng là: C
Đáp án cần chọn là: C
Đáp án đúng là: B
Đáp án cần chọn là: B
Quảng cáo
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com


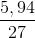 .1,5 = 0,33 (mol)
.1,5 = 0,33 (mol)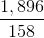 .2,5 = 0,03 (mol)
.2,5 = 0,03 (mol)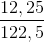 .1,5 = 0,15 (mol)
.1,5 = 0,15 (mol)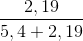 .100% = 28,85%
.100% = 28,85%








