Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ bằng dung dịch chuẩn HCl 0,1 M
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ bằng dung dịch chuẩn HCl 0,1 M với chỉ thị phenolphtalein được tiến hành như sau:
+ Burette (loại 25 mL) đã được đổ đẩy đến vạch 0 bằng dung dịch NaOH và chắc chắn không còn bọt khí trong burette. Cho 10 mL dung dịch chuẩn HCl vào bình tam giác (loại 100 mL), thêm 2 giọt chỉ thị phenolphthalein.
+ Mở khóa burette để nhỏ từ từ giọt dung dịch NaOH vào bình tam giác, đồng thời lắc đều bình. Tiếp tục nhỏ dung dịch NaOH (vẫn duy trì lắc đều bình) tới khi dung dịch trong bình chuyển từ không màu sang màu hồng và bền trong ít nhất 20 giây thì kết thúc chuẩn độ (khóa burette). Ghi lại thể tích đã dùng. Lặp lại ít nhất 3 lần.
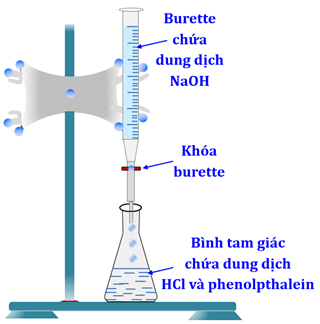
Hãy cho biết những phát biểu sau là đúng hay sai?
| Đúng | Sai | |
|---|---|---|
| a) Bản chất của phản ứng chuẩn độ trên như sau: H+ + OH– ⟶ H2O. | ||
| b) Có thể thay dung dịch chuẩn HCl bằng dung dịch HNO3 có thu được kết quả chuẩn độ có sai số nhỏ hơn. | ||
| c) Có thể hoán đổi vị trí giữa hai dung dịch NaOH và HCl để thu được kết quả chuẩn độ có sai số nhỏ hơn. | ||
| d) Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH (tính trung bình sau 3 lần chuẩn độ) đã sử dụng ở burette là 10,27 mL, nồng độ của dung dịch NaOH là 0,097M. |
Đáp án đúng là: Đ; S; S; Đ
Quảng cáo
Dựa vào lí thuyết về phương pháp chuẩn độ acid - base.
Đáp án cần chọn là: Đ; S; S; Đ
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











