Trong phương pháp chuẩn độ acid - base, xung quanh điểm tương đương có một sự thay
Trong phương pháp chuẩn độ acid - base, xung quanh điểm tương đương có một sự thay đổi pH đột ngột gọi là bước nhảy chuẩn độ. Đường biểu diễn trên đồ thị chuẩn độ acid - base gọi là đường định phân.
Đồ thị dưới đây biểu diễn sự biến thiên pH của dung dịch thu được khi cho từ từ dung dịch X nồng độ 0,10 M vào dung dịch chất Y (chưa biết nồng độ). Biết rằng X, Y là hai chất trong theo thứ tự gồm HCl và NaOH.
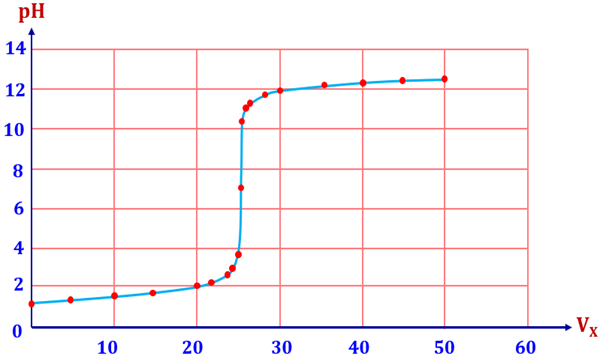
Hãy cho biết những phát biểu sau là đúng hay sai?
| Đúng | Sai | |
|---|---|---|
| a) Trong quá trình chuẩn độ trên, dung dịch X là HCl (dung dịch chuẩn), dung dịch Y là NaOH. | ||
| b) Tại giá trị pH > 7, dung dịch thu được chứa các chất tan gồm chứa muối và kiềm dư. | ||
| c) Bước nhảy chuẩn độ ở khoảng pH từ 3,7 đến 10,3 và tại khoảng pH đó, thể tích dung dịch X ít thay đổi nhất. | ||
| d) Khi đã dùng hết 50 mL dung dịch X, dung dịch thu được có [OH–] < 10–2 M. |
Đáp án đúng là: S; Đ; Đ; S
Quảng cáo
Dựa vào lí thuyết về phương pháp chuẩn độ acid - base.
Đáp án cần chọn là: S; Đ; Đ; S
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











