Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng:Na2S2O3 + H2SO4 ⟶ Na2SO4 + S +
Nghiên cứu ảnh hưởng của nồng độ đến tốc độ phản ứng:
Na2S2O3 + H2SO4 ⟶ Na2SO4 + S + SO2 + H2O
Chuẩn bị: Các dung dịch sodium thiosulfate Na2S2O3 0,05 M, Na2S2O3 0,10 M, Na2S2O3 0,20 M và sulfuric acid H2SO4 0,5 M; 3 cốc thuỷ tinh, đồng hồ bấm giờ, tờ giấy trắng có kẻ chữ X.
Tiến hành:
- Cho vào mỗi cốc thuỷ tinh 30 mL dung dịch Na2S2O3 với các nồng độ tương ứng là 0,05 M; 0,10 M và 0,20 M. Đặt các bình lên tờ giấy trắng có kẻ sẵn chữ X.
- Rót nhanh vào mỗi bình 30 mL dung dịch H2SO4 0,5 M (nồng độ không đổi) và bắt đầu bấm giờ.
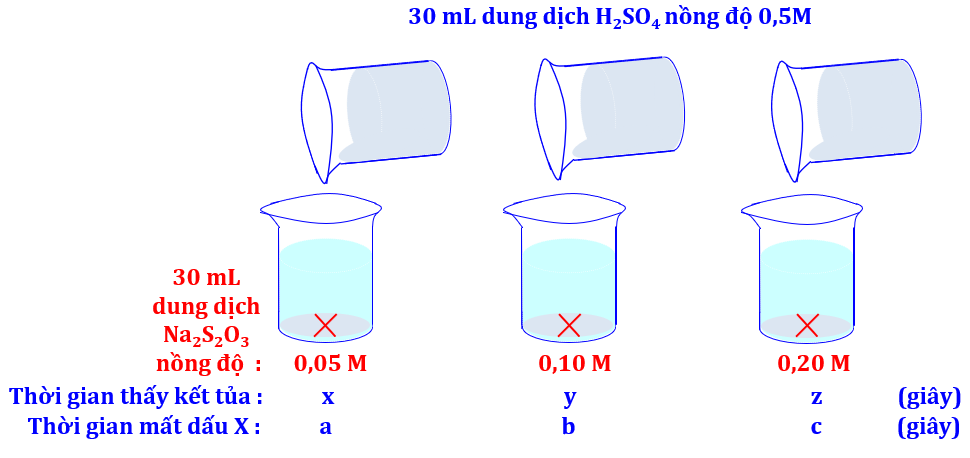
Quan sát vạch chữ X trên tờ giấy dưới đáy bình, ghi lại thời điểm không nhìn thấy vạch chữ X nữa. Những nhận xét nào sau đây là đúng ?
(1) Sau một thời gian, kết tủa S màu vàng bám đầy dưới đáy cốc thủy tinh nên không nhìn thấy vạch chữ X nữa.
(2) Phản ứng có sinh ra khí độc, cần tiến hành cẩn thận và tránh ngửi trực tiếp trên miệng cốc thuỷ tinh.
(3) Các giá trị được sắp xếp theo theo chiều tăng dần như sau : x < y < z và a < b < c.
(4) Thí nghiệm trên chứng tỏ khi tăng nồng độ các chất tham gia, tốc độ phản ứng sẽ tăng.
(5) Lượng thể tích và nồng độ dung dịch H2SO4 cho vào 3 cốc luôn phải bằng nhau.
(6) Lượng S (sulfur) sinh ra ở cốc chứa dung dịch Na2S2O3 0,2 M nhiều nhất.
Đáp án đúng là: D
Quảng cáo
Dựa vào lý thuyết về các yếu tố ảnh hưởng đến tốc độ phản ứng
Đáp án cần chọn là: D
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











