Cho cân bằng sau trong bình kín: 2NO2 (k) N2O4 (k) ở 250C
Cho cân bằng sau trong bình kín: 2NO2 (k) 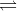 N2O4 (k) ở 250C
N2O4 (k) ở 250C
(màu nâu đỏ) (không màu)
a) Viết công thức electron, công thức cấu tạo của NO2 và N2O4. Xác định cộng hoá trị và
số oxi hoá của N trong các hợp chất đó. Tại sao NO2 có thể đime hoá thành N2O4.
Cho N (Z=7); O(Z=8)
b) Khi giảm nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 tăng lên. Vậy khi hạ nhiệt
độ của bình thì màu nâu đỏ đậm lên hay nhạt đi? Phản ứng thuận toả nhiệt hay thu
nhiệt? Tại sao?
c) Khi tăng áp suất thì cân bằng trên chuyển dịch theo chiều nào? Tại sao?
d) Cho 18,4 gam N2O4 vào bình dung tích 5,904 lít ở 270C. Lúc cân bằng, áp suất của
hỗn hợp khí trong bình là 1 atm (nhiệt độ 270C).
Quảng cáo
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com





 2 NO2 (k)
2 NO2 (k)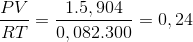 mol
mol =>
=> 








