CHẤT CHỈ THỊ ACID – BASE Thuật ngữ acid hoặc base (acid hoặc kiềm) vẫn thường xuất hiện
CHẤT CHỈ THỊ ACID – BASE
Thuật ngữ acid hoặc base (acid hoặc kiềm) vẫn thường xuất hiện rất phổ biến trong đời sống gia đình. Để nhận biết một dung dịch có môi trường là acid hay là base người ta sử dụng tới chất chỉ thị acid – base. Chất chỉ thị acid – base là chất có màu sắc biến đổi phụ thuộc vào giá trị pH của dung dịch. Một trong những chất chỉ thị thông dụng nhất trong các kĩ thuật chuẩn độ acid - base đó là phenolphthalein.
Adolf van Bayer đã phát hiện ra phenolphtalein vào năm 1871. Ông đã quan sát thấy sự hình thành của phenolphtalein khi đun nóng phenol với phthalic anhydride với sự có mặt của acid:
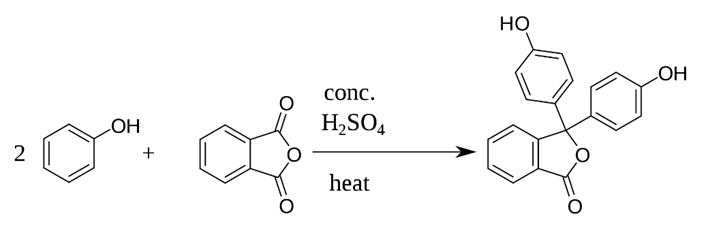
Phenolphthalein là chất rắn kết tinh không màu, đôi khi nó có thể ở dạng bột màu vàng nhạt hoặc màu cam. Đây là một chất không tan trong nước nhưng tan trong cồn. Ở trạng thái tự nhiên, phenolphtalein tồn tại ở dạng acid yếu không màu, được kí hiệu là HIn. Hằng số phân li acid (Ka) của HIn là $3.10^{- 10}$. Base liên hợp của nó có màu đỏ hồng đậm. Trong dung dịch nước, phenolphthalein sẽ có trạng thái cân bằng như sau:
$\left. HIn + H_{2}O\rightleftharpoons In^{-} + H_{3}O^{+} \right.$
Theo nguyên lý chuyển dịch cân bằng Le Chatelier, trạng thái cân bằng trên sẽ chuyển dịch sang trái nếu nồng độ của H3O+ tăng lên, tức là trong dung dịch ưu tiên chiều phản ứng: $\left. In^{-} + H_{3}O^{+}\rightarrow HIn + H_{2}O \right.$ hơn. Nếu dung dịch có tính base mạnh thì cân bằng chuyển dịch sang phải vì ion OH− sẽ phản ứng với các phân tử HIn chuyển hóa thành In−.
Trong các phép chuẩn độ, phenolphtalein được thêm vào để nhận ra điểm dừng chuẩn độ. Tại điểm này có sự thay đổi màu sắc đột ngột của dung dịch được chuẩn độ vì có sự thay đổi của pH trong môi trường chuẩn độ làm thay đổi trạng thái tồn tại của chất chỉ thị mà, từ đó màu của chỉ thị sẽ thay đổi là một dấu hiệu nhận biết đã đến lúc cần dừng chuẩn độ. Người ta coi rằng có một pH trung gian nào đó một nửa phenolphtalein ở dạng acid và một nửa ở dạng base liên hợp có màu. Độ pH trung gian này có thể được tính theo phương trình Henderson – Hasselbalch cho trạng thái cân bằng chỉ thị: $pH = pKa + \log\dfrac{\lbrack In^{-}\rbrack}{\lbrack HIn\rbrack}$.
Trả lời cho các câu 1, 2, 3, 4, 5, 6, 7 dưới đây:
Công thức phân tử của hợp chất phenolphtalein là
Đáp án đúng là: A
Phenolphtalein hình thành khi đun nóng phenol với phthalic anhydride với sự có mặt của acid.
Đáp án cần chọn là: A
Chọn các đáp án đúng
Thành phần và cấu trúc của phân tử phenolphthalein gồm
Đáp án đúng là: A; C; E; F
Quan sát đặc điểm cấu tạo của phenolphtalein.
Đáp án cần chọn là: A; C; E; F
Các nhận định dưới đây là đúng hay sai?
Những yếu tố chỉ ra rằng phenolphthalein là acid yếu là:
| Đúng | Sai | |
|---|---|---|
| a) Trong cấu trúc của phenolphthalein có 2 vòng phenol có tính acid yếu nên gây cho phenolphthalein có tính acid yếu. | ||
| b) Trong cấu trúc của phenolphthalein có nhóm chức của carboxylic acid nên gây ra tính acid yếu của phenolphthalein. | ||
| c) Ka của acid HIn rất nhỏ, do đó khả năng phân li ra ion H+ của acid này rất yếu, nên tính acid của HIn yếu. |
Đáp án đúng là: Đ; S; Đ
Tính acid của phenolphtalein.
Đáp án cần chọn là: Đ; S; Đ
Điền số thích hợp vào chỗ trống (Làm tròn đến chữ số thập phân thứ nhất)
pH trung gian mà tại đó người ta mong chờ có sự đổi màu của chỉ thị phenolphtalein là _______.
Đáp án đúng là: 9,5
pH = -log(Ka)
Đáp án cần điền là: 9,5
Kéo thả các đáp án vào vị trí thích hợp:
Khi cho phenolphthalein vào cốc đựng dung dịch nước chanh có pH = 2,4 thì chỉ thị . Khi cho phenolphthalein vào cốc đựng dung dịch Ba(OH)2 nồng độ 0,1M thì nồng độ của trong dung dịch lớn hơn nồng độ của .
Đáp án đúng là: không màu; In-; HIn
Sự thay đổi màu chỉ thị của phenolphtalein trong môi trường acid/base.
Đáp án cần chọn là: không màu; In-; HIn
Để tổng hợp 18 mol phenolphtalein theo quá trình đã được Adolf van Bayer đã phát hiện ra vào năm 1871 cần bao nhiêu gam chất phản ứng? Biết phản ứng có hiệu suất 90%
Đáp án đúng là: D
Tính theo PTHH và hiệu suất để được nphenol và nphthalic anhydride
mphản ứng = mphenol + mphthalic anhydride .
Đáp án cần chọn là: D
Nhận định dưới đây là đúng hay sai?
Nồng độ ion H+ ảnh hưởng tới trạng thái tồn tại của HIn
Đáp án đúng là: A
Lý thuyết về sự chuyển dịch cân bằng.
Đáp án cần chọn là: A
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











