Điện phân 400 ml dung dịch 2 muối KCl và CuCl2 với điện cực trơ và màng ngăn cho đến khi ở
Điện phân 400 ml dung dịch 2 muối KCl và CuCl2 với điện cực trơ và màng ngăn cho đến khi ở anot thoát ra 3,36 lít khí (đktc) thì ngừng điện phân. Để trung hòa dung dịch sau điện phân cần 100 ml dung dịch HNO3 0,6M. Dung dịch sau trung hòa tác dụng với AgNO3 dư sinh ra 2,87 gam kết tủa trắng. Nồng độ mol của mỗi muối trong dung dịch trước điện phân là:
Đáp án đúng là: D
Quảng cáo
Đáp án cần chọn là: D
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com



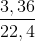 = 0,15 mol
= 0,15 mol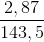 = 0,02 mol
= 0,02 mol Cu
Cu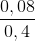 = 0,2M
= 0,2M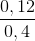 = 0,3M
= 0,3M







