Orbital nguyên tử là các vùng không gian quanh hạt nhân của nguyên
Orbital nguyên tử là các vùng không gian quanh hạt nhân của nguyên tử, nơi electron có xác suất cao nhất xuất hiện. Các orbital này được mô tả bởi bốn số lượng tử chính: số lượng tử chính (n), số lượng tử động lượng góc (l), số lượng tử từ (m), và số lượng tử spin (s). Các số lượng tử này có mối quan hệ chặt chẽ với nhau và giúp xác định đặc tính của từng orbital trong nguyên tử.
1. Số lượng tử chính (n): Quy định mức năng lượng của electron và khoảng cách của electron so với hạt nhân. Nó tương ứng với số thứ tự lớp electron:

2. Số lượng tử động lượng góc (l): Quy định hình dạng của orbital. Giá trị của l có thể nhận các giá trị từ 0 đến (n-1).
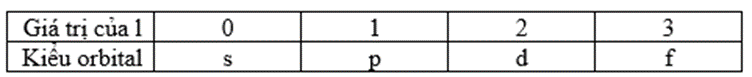
3. Số lượng tử từ (m): Quy định phương hướng của orbital trong không gian. Mỗi giá trị của m tương ứng với một hướng trong không gian ba chiều và có thể nhận các giá trị từ -l đến +l.
4. Số lượng tử spin (s): Đặc trưng cho chuyển động xung quanh trục riêng của electron. Nó chỉ gồm 2 giá trị $\frac{1}{2}$ và $\frac{-1}{2}$ được kí hiệu tương ứng với 2 dấu mũi tên ($\uparrow $) và ($\downarrow $) ứng với 2 electron trong 1 AO.
Trả lời cho các câu 1, 2, 3, 4, 5, 6 dưới đây:
Số lượng tử nào dưới đây không ảnh hưởng trực tiếp đến hình dạng của orbital trong mô hình nguyên tử?
Đáp án đúng là: D
Dựa vào thông tin ở bài đọc.
Đáp án cần chọn là: D
Khi số lượng tử chính là 3 thì số các giá trị số lượng tử động lượng góc nhận được là _______.
Đáp án đúng là: 3
Giá trị của l có thể nhận các giá trị từ 0 đến (n-1).
Đáp án cần điền là: 3
Hai electron trong cùng một orbital phải có số lượng tử spin nghịch từ, tức là một electron có spin $\dfrac{1}{2}$ và một electron có spin $\dfrac{- 1}{2}$, để tuân theo nguyên lý loại trừ Pauli.
Đáp án đúng là: A
Dựa vào lý thuyết về số lượng tử spin.
Đáp án cần chọn là: A
Nếu số lượng tử chính (n) của electron là 4 và số lượng tử động lượng góc (l) là 2, thì giá trị nào dưới đây không thể là số lượng tử từ (m) của electron?
Đáp án đúng là: D
Dựa vào giá trị quy định của số lượng tử từ.
Đáp án cần chọn là: D
Trong một nguyên tử, electron có các giá trị của số lượng tử như sau: n = 3, l = 1, m = -1, và s=$\dfrac{1}{2}$. Những kết luận nào sau đây là đúng? Chọn tất cả các câu đúng.
Đáp án đúng là: B; D; E
Dựa vào thông tin ở bài đọc về các số lượng tử.
Đáp án cần chọn là: B; D; E
Kéo thả các số lượng tử vào các đặc điểm phù hợp:
Đáp án đúng là: 1-a; 2-d; 3-c; 4-b
Dựa vào thông tin ở bài đọc.
Đáp án cần chọn là: 1-a; 2-d; 3-c; 4-b
Quảng cáo
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











