Trong bảng tuần hoàn, các nguyên tố hoá học được sắp xếp theo số hiệu
Trong bảng tuần hoàn, các nguyên tố hoá học được sắp xếp theo số hiệu nguyên tử, từ đó bộc lộ những xu hướng biến đổi tuần hoàn về cấu tạo và tính chất. Trước hết, bán kính nguyên tử thể hiện quy luật rõ rệt: trong một chu kì, từ trái sang phải, số proton hạt nhân tăng, lực hút tĩnh điện giữa hạt nhân và electron lớn dần trong khi số lớp electron không đổi, làm bán kính nguyên tử giảm. Ngược lại, khi xét từ trên xuống dưới một nhóm, số lớp electron tăng thêm, hiệu ứng che chắn mạnh hơn nên bán kính nguyên tử tăng lên.
Sự thay đổi bán kính kéo theo sự biến đổi của độ âm điện – đại lượng đặc trưng cho khả năng hút electron trong liên kết. Trong cùng một chu kì, khi bán kính giảm thì độ âm điện tăng, còn trong một nhóm, bán kính tăng làm độ âm điện giảm. Xu hướng này ảnh hưởng trực tiếp đến mức độ thể hiện tính kim loại và tính phi kim. Cụ thể, trong một chu kì, từ trái sang phải, tính kim loại giảm dần còn tính phi kim tăng dần; ngược lại, trong một nhóm, từ trên xuống dưới, tính kim loại tăng dần, tính phi kim giảm dần.
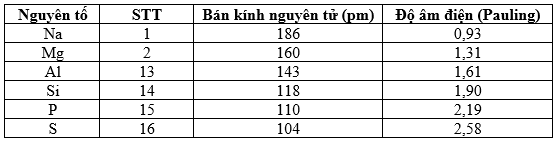
Dưới đây là bảng số liệu về bán kính nguyên tử và độ âm điện của các nguyên tố ở chu kì 3.
Trả lời cho các câu 1, 2, 3, 4, 5, 6 dưới đây:
Khi đi từ trái sang phải trong một chu kì, sự thay đổi nào sau đây là đúng?
Đáp án đúng là: B
Dựa vào xu hướng biến đổi các tính chất trong cùng một chu kì.
Đáp án cần chọn là: B
Độ âm điện tăng dần từ Na (0,93) → Cl (3,16) dẫn đến sự thay đổi nào?
Đáp án đúng là: A
Dựa vào ảnh hưởng sự biến đổi độ âm điện của các nguyên tố.
Đáp án cần chọn là: A
Xét các phát biểu sau về các nguyên tố Na, Mg, Al, Si, P, S, Cl trong chu kì 3:
| Đúng | Sai | |
|---|---|---|
| a) Na có bán kính nguyên tử lớn hơn Mg vì nằm ở đầu chu kì. | ||
| b) Cl có độ âm điện cao nhất trong chu kì 3 nên thường tạo hợp chất cộng hoá trị phân cực mạnh. | ||
| c) Trong chu kì 3, P có tính kim loại mạnh hơn Mg. | ||
| d) Bán kính nguyên tử của Si nhỏ hơn Al nên Si thể hiện tính phi kim rõ hơn. |
Đáp án đúng là: Đ; Đ; S; Đ
Dựa vào xu hướng biến đổi các tính chất của các nguyên tố chu kì 3.
Đáp án cần chọn là: Đ; Đ; S; Đ
Trong chu kì 3, bán kính nguyên tử giảm dần từ Na (186 pm) đến Cl (99 pm) vì số proton hạt nhân tăng, lực hút electron mạnh hơn, trong khi số lớp electron ______.
Đáp án đúng là: không đổi
Dựa vào đặc điểm cấu hình nguyên tử của các nguyên tố chu kì 3.
Đáp án cần điền là: không đổi
Cho các nguyên tố có số hiệu nguyên tử: K (Z = 19); Ca (Z = 20); O (Z = 8); F (Z = 9).
Hãy sắp xếp các nguyên tố trên theo chiều tăng dần tính kim loại.
Đáp án đúng là: 3-4-2-1
Dựa vào xu hướng biến đổi tính chất của các nguyên tố trong cùng một nhóm, chu kì.
Đáp án cần chọn là: 3-4-2-1
Trong phòng thí nghiệm, một HS để riêng hai mẫu kim loại K (Z=19) và Ca (Z=20) ngoài không khí ẩm. Sau một thời gian, cả hai đều bị biến đổi hoá học. Phát biểu nào sau đây giải thích đúng và đầy đủ nhất hiện tượng trên?
Đáp án đúng là: B; C
Phân tích vị trí của 2 nguyên tố K và Ca trong bảng tuần hoàn, từ đó xác định tính chất.
Đáp án cần chọn là: B; C
Quảng cáo
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











