CO2
Thuyết các cặp electron lớp vỏ hóa trị đẩy nhau (VSEPR – Valence Shell Electron Pair Repulsion)
Thuyết các cặp electron lớp vỏ hóa trị đẩy nhau (VSEPR – Valence Shell Electron Pair Repulsion) được xây dựng dựa trên giả thuyết rằng các cặp electron quanh nguyên tử trung tâm sẽ đẩy nhau để đạt vị trí xa nhau nhất, giúp hệ có năng lượng thấp nhất. Cách sắp xếp này quyết định hình học của phân tử.
Theo mô hình VSEPR, công thức tổng quát của phân tử được ký hiệu là AXnEm, trong đó A là nguyên tử trung tâm, X là số nguyên tử liên kết, E là số cặp electron chưa liên kết. Tổng số vùng mật độ electron N = n + m. Số vùng mật độ electron này quyết định dạng hình học của phân tử theo bảng sau:
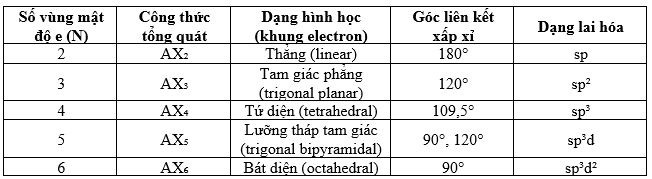
Khi xuất hiện các cặp electron tự do, góc liên kết bị giảm do lực đẩy của cặp electron tự do lớn hơn. Ví dụ: CH4 có góc H–C–H là 109,5°, NH3 có 107°, H2O còn 104,5°.
Thuyết VSEPR kết hợp với thuyết lai hóa giúp giải thích bản chất liên kết: các orbital nguyên tử s, p, d trên nguyên tử trung tâm lai hóa để tạo ra các orbital định hướng trong không gian phù hợp với hình dạng phân tử thực tế. Dạng lai hóa càng cao, khả năng định hướng liên kết càng linh hoạt.
Thuyết này có nhiều ứng dụng trong dự đoán hình dạng, độ cực, và tính phản ứng của phân tử. Trong công nghệ dược phẩm, hình học phân tử quyết định khả năng gắn kết của thuốc vào thụ thể. Trong vật liệu học, hiểu được cấu trúc không gian của các hợp chất như SiCl4, SF6 hay NH3 giúp điều khiển cấu trúc nano và đặc tính của vật liệu.
Trả lời cho các câu 1, 2, 3, 4, 5 dưới đây:
Tổng số vùng mật độ electron quyết định dạng hình học của phân tử.
Đáp án đúng là: A
Dựa vào thông tin đoạn văn.
Đáp án cần chọn là: A
Điền từ có 1 tiếng vào chỗ trống:
Khi số cặp electron tự do quanh nguyên tử trung tâm tăng, góc liên kết _______ do lực đẩy lớn hơn.
Đáp án đúng là: giảm
Dựa vào thông tin bài đọc.
Đáp án cần điền là: giảm
Cho 4 phân tử: CO2, SO2,H2S, H2O.
Theo thuyết VSEPR, hãy sắp xếp thứ tự tăng dần của góc liên kết X–A–X (tức là từ nhỏ đến lớn).
SO2
H2S
H2O
Đáp án đúng là: 3-4-2-1
Dựa vào thuyết VSEPR, xác định góc liên kết của các chất.
Đáp án cần chọn là: 3-4-2-1
Ghép mỗi phân tử hoặc ion ở cột A với kiểu lai hóa của nguyên tử trung tâm ở cột B.
BeCl2
BF3
CH4
PCl5
SF6
Đáp án đúng là: 1-c; 2-d; 3-b; 4-e; 5-a
Phân tích đặc điểm lai hóa của các chất.
Đáp án cần chọn là: 1-c; 2-d; 3-b; 4-e; 5-a
Trong các phân tử sau: BeCl2, BF3, CH4, PCl5, phân tử nào không thể hình thành nếu nguyên tử trung tâm không sử dụng orbital d để lai hóa?
Đáp án đúng là: C
Phân tích đặc điểm lai hóa của các chất.
Đáp án cần chọn là: C
Quảng cáo
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











