Cho bảng số liệu
Cho bảng số liệu sau:
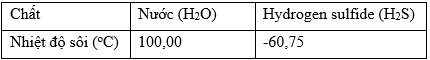
| Đúng | Sai | |
|---|---|---|
| a) Do có liên kết hydrogen giữa các phân tử nên nước có nhiệt độ sôi cao hơn hydrogen sulfide. | ||
| b) Trong phân tử H2O và phân tử H2S chỉ có các liên kết cộng hóa trị. | ||
| c) Ở điều kiện thường, H2O tồn tại ở trạng thái lỏng, H2S tồn tại ở trạng thái khí. | ||
| d) Liên kết O‒H trong phân tử H2O kém phân cực hơn liên kết S‒H trong phân tử H2S. |
Đáp án đúng là: Đ; Đ; Đ; S
Quảng cáo
a) Ảnh hưởng của liên kết hydrogen đến nhiệt độ nóng chảy, nhiệt độ sôi của các chất.
b) Liên kết trong phân tử H2O và H2S.
c) Căn cứ vào nhiệt độ sôi của H2O và H2S để suy ra được trạng thái tồn tại của chất.
d) So sánh độ âm điện của O và S để suy ra độ phân cực của liên kết O-H và S-H.
Đáp án cần chọn là: Đ; Đ; Đ; S
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











