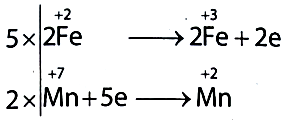Trong phòng thí nghiệm, nồng độ FeSO4 được xác định bằng phản ứng với dung dịch KMnO4 trong
Trong phòng thí nghiệm, nồng độ FeSO4 được xác định bằng phản ứng với dung dịch KMnO4 trong môi trường acid H2SO4 loãng:
$\left. \text{FeSO}_{4} + \text{KMnO}_{4} + \text{H}_{2}\text{SO}_{4}\rightarrow\text{Fe}_{2}\left( \text{SO}_{4} \right)_{3} + \text{K}_{2}\text{SO}_{4} + \text{MnSO}_{4} + \text{H}_{2}\text{O} \right.$
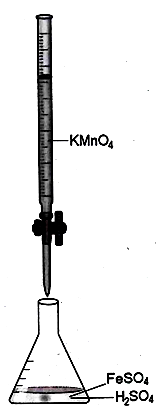
Sơ đồ bố trí dụng cụ thí nghiệm được mô tả như hình vẽ bên.
a) Lập phương trình hoá học của phản ứng theo phương pháp thăng bằng electron.
b) Dấu hiệu nào cho biết thời điểm dừng chuẩn độ?
c) Xác định nồng độ mol của dung dịch FeSO4, biết chuẩn độ 10ml dung dịch FeSO4 cần 9,60 mL dung dịch KMnO4 0,02M.
Quảng cáo
a) Cân bằng PTHH bằng phương pháp thăng bằng electron.
b) Dấu hiệu dừng chuẩn độ.
c) CFeSO4 = $\dfrac{5.C_{KMnO4}.V_{KMnO4}}{V_{FeSO4}}$
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com