Cho x mol Al tan hết trong V lít dung dịch H2SO4 1M và HCl 1M, thu được dung dịch Y. Cho từ từ đến
Cho x mol Al tan hết trong V lít dung dịch H2SO4 1M và HCl 1M, thu được dung dịch Y. Cho từ từ đến dư dung dịch Ba(OH)2 vào Y, khối lượng kết tủa tạo thành phụ thuộc vào số mol Ba(OH)2 được biểu diễn trên đồ thị sau: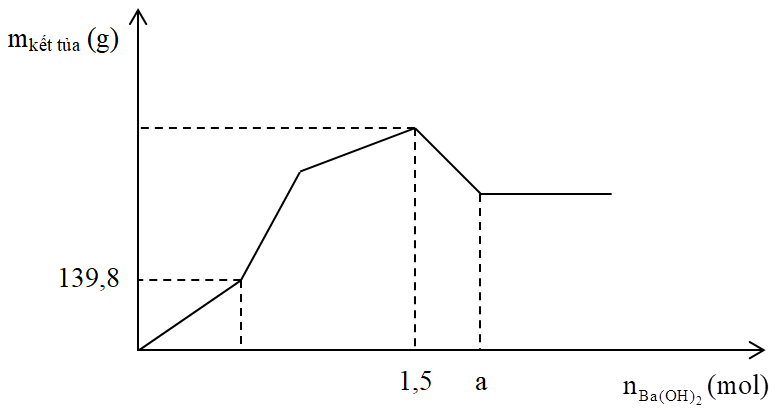
Tỉ lệ a : x có giá trị là
Đáp án đúng là: D
Quảng cáo
Đặt \({n_{{H_2}S{O_4}}} = {n_{HCl}} = b(mol)\)
- Do ban đầu kết tủa tăng chậm (chỉ tạo BaSO4) sau đó tăng nhanh hơn (tạo đồng thời BaSO4 và Al(OH)3)
→ Dung dịch Y có chứa H+ dư; Al3+; SO42-; Cl-
- Phản ứng diễn ra 2 quá trình tạo kết tủa độc lập là:
+) Tạo BaSO4:
Ba2+ + SO42- → BaSO4 (1)
+) Tạo Al(OH)3:
H+ + OH- → H2O (2)
Al3+ + 3OH- → Al(OH)3 (3)
Al(OH)3 + OH- → AlO2- + 2H2O (4)
Gọi các điểm gấp khúc của đồ thị lần lượt là A, B, C, D.
- Tại A kết tủa bắt đầu tăng nhanh → (1) đang xảy ra và (2) vừa kết thúc
→ H+ bị trung hòa hết; Al(OH)3 chưa tạo thành, kết tủa chỉ có BaSO4:
\( \to {n_{Ba{{(OH)}_2}}} = {n_{BaS{O_4}}}\)
Mà phản ứng trung hòa: \({n_{{H^ + }}} = {n_{O{H^ - }}}\) → Giá trị của b
\( \to {n_{S{O_4}^{2 - }}} = {n_{{H_2}S{O_4}}}\)
\( \to {n_{BaS{O_4}\max }} = {n_{S{O_4}^{2 - }}}\)
- Tại C kết tủa đạt giá trị lớn nhất nên có kết tủa nào đó đạt cực đại:
Mà ta thấy \({n_{Ba{{(OH)}_2}}} > {n_{BaS{O_4}\max }}\) → BaSO4 đã kết tủa cực đại điểm trước đó (là điểm B)
→ Tại C thì Al(OH)3 đạt cực đại
Khi Al(OH)3 max thì: \({n_{O{H^ - }}} = {n_{{H^ + }}} + 3{n_{A{l^{3 + }}}}\) → Giá trị của x
- Tại điểm D thì Al(OH)3 vừa bị tan hết:
\( \to {n_{O{H^ - }}} = {n_{{H^ + }}} + 4{n_{A{l^{3 + }}}}\) → Giá trị của a
Đáp án cần chọn là: D
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











