Cho 2,13 gam P2O5 vào dung dịch có chứa 1,6 gam NaOH, thêm nước vào cho vừa đủ 400 ml. Tính CM của
Cho 2,13 gam P2O5 vào dung dịch có chứa 1,6 gam NaOH, thêm nước vào cho vừa đủ 400 ml. Tính CM của các muối trong dung dịch thu được?
Đáp án đúng là: B
Quảng cáo
Các phản ứng xảy ra:
P2O5 + 3H2O → 2H3PO4
H3PO4 + OH- → H2PO4- + H2O
H3PO4 + 2OH- → HPO42- + 2H2O
H3PO4 + 3OH- → PO43- + 3H2O
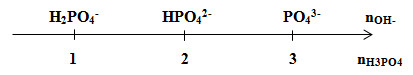
Giải thích trục số:
Đặt \((*) = \frac{{{n_{O{H^ - }}}}}{{{n_{{H_3}P{O_4}}}}}\)
+ Nếu (*) < 1 → H3PO4 dư và H2PO4-
+ Nếu (*) = 1 → H2PO4-
+ Nếu 1 < (*) < 2 → H2PO4- và HPO42-
+ Nếu (*) = 2 → HPO42-
+ Nếu 2 < (*) < 3 → HPO42- và PO43-
+ Nếu (*) = 3 → PO43-
+ Nếu (*) > 3 → PO43- và OH‑ dư
Dựa vào tỉ lệ (*) để xác định sản phẩm thu được. Từ đó tính toán theo phương trình tìm được số mol chất tan thu được sau phản ứng và CM của các muối trong dung dịch.
Đáp án cần chọn là: B
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











