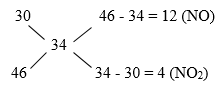Hỗn hợp X gồm Fe, FeS, FeS2, Cu, Cu2S, CuS, S. Đốt cháy hoàn toàn m gam hỗn hợp X trong khí O2 dư,
Hỗn hợp X gồm Fe, FeS, FeS2, Cu, Cu2S, CuS, S. Đốt cháy hoàn toàn m gam hỗn hợp X trong khí O2 dư, sau phản ứng thu được chất rắn Y có khối lượng giảm 8 gam so với X. Mặt khác, hòa tan hoàn toàn X bằng dung dịch HNO3 đặc, nóng, dư sau phản ứng thu được 43,008 lít (đktc) hỗn hợp khí NO và NO2 có tỉ khối so với H2 bằng 17 và dung dịch Z. Cho dung dịch Z tác dụng với Ba(OH)2 dư thu được 187,42 gam kết tủa. Khi hòa tan hoàn toàn m gam hỗn hợp X bằng H2SO4 đặc, nóng, dư thu được V lít khí SO2 (đktc, sản phẩm khử duy nhất). Giá trị của V là
Đáp án đúng là: D
Quảng cáo
- Coi hỗn hợp X gồm Fe (x mol), Cu (y mol), S (z mol)
⟹ Chất rắn Y gồm Fe2O3 (0,5x mol) và CuO (y mol)
- Lập hệ phương trình dựa vào:
+ Chất rắn Y có khối lượng giảm so với X
+ Bảo toàn electron
+ Khối lượng kết tủa khi cho dd Z tác dụng với Ba(OH)2 dư (lưu ý: kết tủa gồm Fe(OH)3, Cu(OH)2, BaSO4)
Đáp án cần chọn là: D
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com