Có thể xác định nồng độ của permanganate (\(MnO_4^ - \)) trong dung dịch bằng cách
Có thể xác định nồng độ của permanganate (\(MnO_4^ - \)) trong dung dịch bằng cách chuẩn độ với dung dịch oxalic acid (H2C2O4) đã biết nồng độ theo phương trỉnh hoá học sau:
$2MnO_4^ - + 5{C_2}O_4^{2 - } + 16{H^ + }\xrightarrow{{}}2M{n^{2 + }} + 12C{O_2} + 8{H_2}O$
Phản ứng xảy ra rất chậm ở nhiệt độ phòng. Mn2+ là xúc tác cho phản ứng nên phản ứng trên được gọi là phản ứng tự xúc tác.
Trong phép chuẩn độ này, cần phải cho dung dịch \(MnO_4^ - \) trên buret, còn dung dịch H2C2O4 được đề trong bình tam giác.
| Đúng | Sai | |
|---|---|---|
| a) Dừng chuẩn độ khi dung dịch trong bình tam giác xuất hiện màu tím bền trong 10 giây. |
||
| b) Cần duy trì môi trường acid trong quá trình chuẩn độ để \(MnO_4^ - \) bị oxi hóa thành Mn2+. |
||
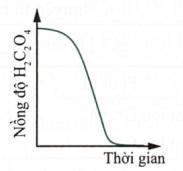
| c) Nồng độ dung dịch H2C2O4 ban đầu giảm chậm sau đó giảm nhanh dần. |
||
| d) Nồng độ của permanganate được tính theo công thức: \({C_{MnO_4^ - }} = \dfrac{{2.{C_{{H_2}{C_2}{O_4}}}.{V_{{H_2}{C_2}{O_4}}}}}{{5.{V_{MnO_4^ - }}}}\) |
Đáp án đúng là: Đ; S; Đ; Đ
Quảng cáo
a) Điểm dừng chuẩn độ khi có sự thay đổi về màu sắc hoặc khí/kết tủa quan sát được bằng mắt.
b) Tính chất hóa học của Mn.
c) Sự thay đổi nồng độ của chất trong quá trình chuẩn độ.
d) Tính mol chất theo phương trình phản ứng.
Đáp án cần chọn là: Đ; S; Đ; Đ
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com