Tốc độ phản ứng (kí hiệu \(\nu \)) của phản ứng hóa học là đại lượng đặc trưng cho sự
Tốc độ phản ứng (kí hiệu \(\nu \)) của phản ứng hóa học là đại lượng đặc trưng cho sự biến thiên nồng độ của chất phản ứng hoặc sản phẩm trong một đơn vị thời gian. Đơn vị tốc độ phản ứng: (đơn vị nồng độ)/(đơn vị thời gian) ví dụ: mol/(L.s) hay mol.L-1.s-.
♦ Tốc độ trung bình của phản ứng (\(\overline \nu \)) là tốc độ được tính trong khoảng thời gian phản ứng.
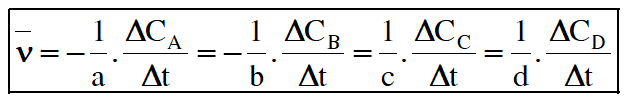
Trong đó: ΔC = C2 – C1, Δt = t2 – t1 lần lượt là biến thiên nồng độ và biến thiên thời gian tương ứng.
C1, C2 là nồng độ của một chất tại thời điểm tương ứng t1, t2.
Trả lời cho các câu 1, 2, 3 dưới đây:
Tốc độ phản ứng là
Đáp án đúng là: B
Khái niệm tốc độ phản ứng.
Đáp án cần chọn là: B
Cho PTHH: CaCO3 + 2HCl CaCl2 + CO2 ↑ + H2O. Công thức tính tốc độ trung bình (mol.L-1.s-) của phản ứng theo CO2 là
Đáp án đúng là: A
Biểu thức tính tốc độ phản ứng trung bình.
Đáp án cần chọn là: A
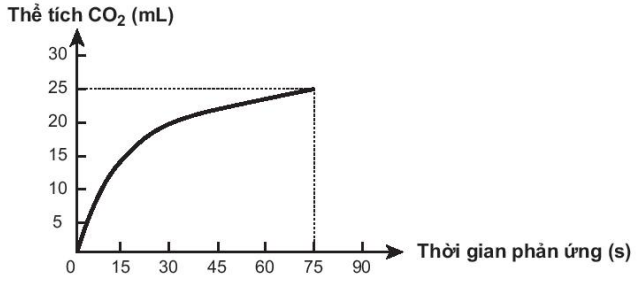
Thực hiện phản ứng sau: CaCO3 + 2HCl $\to $ CaCl2 + CO2 ↑ + H2O. Theo dõi thể tích CO2 thoát ra theo thời gian, thu được đồ thị như sau (thể tích khí được đo ở áp suất khí quyển và nhiệt độ phòng).
Cho các phát biểu sau đây:
(a) Tốc độ trung bình của phản ứng trong khoảng thời gian từ thời điểm đầu đến 75 giây là 1/3 mL/s.
(b) Tốc độ phản ứng giảm dần theo thời gian.
(c) Tốc độ trung bình của phản ứng trong các khoảng thời gian 15 giây là như nhau.
(d) Ở thời điểm 60 giây, tốc độ phản ứng bằng 0.
Số phát biểu đúng là
Đáp án đúng là: 2
a) $v=\frac{\Delta {{C}_{C{{O}_{2}}}}}{\Delta t}$
b) c) d) Quan sát đồ thị kết hợp lí thuyết về tốc độ phản ứng.
Đáp án cần điền là: 2
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











