Cho nhiệt tạo thành chuẩn của một số chất trong bảng
Cho nhiệt tạo thành chuẩn của một số chất trong bảng sau:
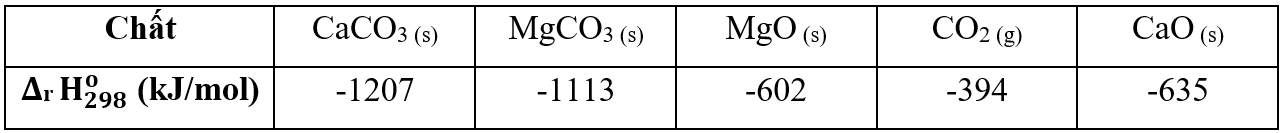
Trả lời cho các câu 1, 2, 3 dưới đây:
Cho phản ứng hóa học sau:
CaCO3(s) ⟶ CaO(s) + CO2(g) (1)
Biến thiên enthalpy chuẩn của phản ứng trên có giá trị là bao nhiêu kJ? (làm tròn kết quả tới chữ số hàng đơn vị)
Đáp án đúng là:
$\Delta_{r}H_{298}^{o} = {\sum{\Delta_{f}H_{298}^{o}(sp)}} - {\sum{\Delta_{f}H_{298}^{o}(cd)}}$
Đáp án cần điền là: 178
Cho phản ứng hóa học sau:
MgO(s) + CO2(g) ⟶ MgCO3(s) (2)
Khi tạo thành 1 mol MgCO3 trong phản ứng (2), năng lượng giải phóng ra là bao nhiêu kJ? (làm tròn kết quả tới chữ số hàng đơn vị)
Đáp án đúng là:
$\Delta_{r}H_{298}^{o} = {\sum{\Delta_{f}H_{298}^{o}(sp)}} - {\sum{\Delta_{f}H_{298}^{o}(cd)}}$
Đáp án cần điền là: 117
Cho các nhận định sau:
(a) Quá trình hình thành muối MgCO3 từ các đơn chất thuận lợi về mặt năng lượng hơn so với quá trình hình thành muối CaCO3 từ các đơn chất.
(b) Phản ứng (1) diễn ra thuận lợi hơn phản ứng (2) về mặt năng lượng.
(c) CaCO3 bền nhiệt hơn so với MgCO3.
(d) Phản ứng CaO (s) + CO2 (s) ⟶ CaCO3 (s) là phản ứng tỏa nhiệt.
(e) Cả CaCO3 và MgCO3 đều có thể tan hoàn toàn trong dung dịch HCl dư.
Có bao nhiêu phát biểu đúng trong các phát biểu trên?
Đáp án đúng là:
Công thức tính giá trị enthalpy của phản ứng:
\({\Delta _r}H_{298}^o = \sum {{\Delta _f}H_{298}^o} (sp) - \sum {{\Delta _f}H_{298}^o} (cd)\)
Đáp án cần điền là: 3
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











