Nghiên cứu và tính toán lượng nhiệt cần thiết cung cấp hoặc thu được sau
Nghiên cứu và tính toán lượng nhiệt cần thiết cung cấp hoặc thu được sau một phản ứng hoá học có nhiều ứng dụng trong đời sống. Ví dụ như: quá trình nung vôi xảy ra phản ứng thu nhiệt mạnh theo phương trình hóa học (1) như sau:
CaCO3(s) $\xrightarrow{{{t^0}}}$ CaO(s) + CO2(g) (1)
Lượng nhiệt để thực hiện phản ứng này được cung cấp từ quá trình đốt cháy hoàn toàn khí thiên nhiên hóa lỏng (chứa 96% methane, 4% ethane về thể tích) theo phương trình hóa học (2) và (3):
CH4 (g) + 2O2(g) $\xrightarrow{{{t^0}}}$ CO2(g) + 2H2I(g) (2)
C2H6(g) + 3,5O2(g) $\xrightarrow{{{t^0}}}$ 2CO2(g) + 3H2O(g) (3)
Biết lượng nhiệt toả ra hay thu vào của chất được tính theo công thức:
\(\begin{array}{l}{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{^{{\rm{298}}}}^{\rm{0}}{\rm{ = }}\sum {{{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{{\rm{Sp}}}^{\rm{0}}} {\rm{ - }}\sum {{{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{{\rm{tgia}}}^{\rm{0}}} \\{{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{^{{\rm{298}}}}^{\rm{0}}{\rm{ = }}\sum {{{\rm{E}}_{{\rm{b,tgia}}}}} {\rm{ - }}\sum {{{\rm{E}}_{{\rm{b,sp}}}}} \end{array}\)
Trong đó, \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{^{{\rm{298}}}}^{\rm{0}}\)được gọi là biến thiên enthalpy của phản ứng = lượng nhiệt toả ra hoặc thu vào của phản ứng. Nếu \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{^{{\rm{298}}}}^{\rm{0}}\)< 0, phản ứng toả nhiệt, \({{\rm{\Delta }}_{\rm{r}}}{\rm{H}}_{^{{\rm{298}}}}^{\rm{0}}\)> 0 phản ứng thu nhiệt.
\({{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{^{{\rm{tgia}}}}^{\rm{0}}{\rm{, }}{{\rm{\Delta }}_{\rm{f}}}{\rm{H}}_{{\rm{sp}}}^{\rm{0}}{\rm{,}}\)lần lượt là nhiệt hình thành của các chất tham gia và chất sản phẩm.
\(\sum {{{\rm{E}}_{{\rm{b,tgia}}}}} {\rm{; }}\sum {{{\rm{E}}_{{\rm{b,sp}}}}} \)lần lượt là tổng năng lượng liên kết của các chất tham gia và chất sản phẩm.
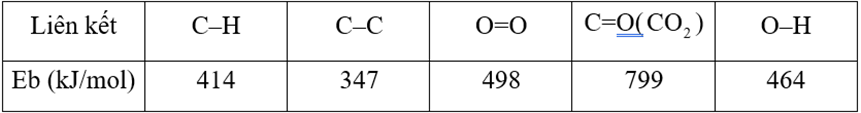
Các giá trị nhiệt tạo thành của các chất, năng lượng liên kết trung bình của một số liên hết hóa học ở điều kiện chuẩn được cho trong bảng sau:
Nhiệt tạo thành chuẩn của các chất:
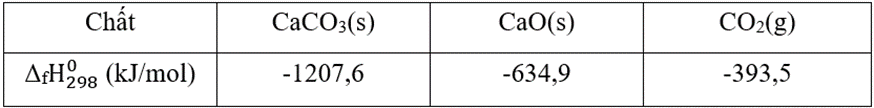
Năng lượng liên kết trung bình của một số liên hết hóa học ở điều kiện chuẩn:
Trả lời cho các câu 1, 2, 3 dưới đây:
Phát biểu nào sau đây là đúng?
Đáp án đúng là: B
Dựa vào lý thuyết và công thức về lượng nhiệt của phản ứng, suy ra được nhận định đúng/sai.
Đáp án cần chọn là: B
Sơ đồ nào sau đây mô tả đúng cho sự thay đổi năng lượng của phản ứng (1)?
Đáp án đúng là: C
Dựa vào dữ kiện về dấu của biến thiên enthalpy, tìm sơ đồ phù hợp.
Đáp án cần chọn là: C
Xét các phản ứng ở điều kiện chuẩn và hiệu suất chuyển hóa của CaCO3 là 100%. Khối lượng khí thiên nhiên hóa lỏng là m tấn cần thiết để sản xuất 280 tấn CaO(s) trong giai đoạn trên. Biết 95% tổng lượng nhiệt tỏa ra từ phản ứng (2), (3) được cung cấp cho phản ứng (1). Giá trị của m là bao nhiêu? (Cho khối lượng nguyên tử của Ca, C, O lần lượt là 4 0amu, 12 amu, 16 amu).
Đáp án đúng là: C
Dựa vào công thức tính, tính được năng lượng toả ra từ phản ứng (2), (3) khi đốt hỗn hợp chứa 0,96 mol khí methane, 0,04 mol khí ethane; năng lượng cần cung cấp cho (1) để tạo 1 mol CaO, 280 tấn CaO.
Từ đó, tính được số mol mỗi khí, khối lượng khí cần để cung cấp cho phản ứng (1).
Đáp án cần chọn là: C
Quảng cáo
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











