Chuần độ acid - base là phương pháp xác định nồng độ sử dụng một lượng chính xác chất
Chuần độ acid - base là phương pháp xác định nồng độ sử dụng một lượng chính xác chất chuẩn (một dung dịch acid hoặc base) để xác định nồng độ dung dịch mẫu đã biết thể tích (acid hoặc base tương ưng). Quá trình này sử dụng chất chỉ thị acid - base (một chất đồi màu theo pH của dung dịch) để thêm vào mẫu hoặc đo độ dẫn điện của dung dịch mẫu. Độ dẫn điện (đo bằng đơn vị kilosiemens trên centimet, kS/cm) là đại lượng đại diện cho khả năng dẫn điện của dung dịch.
Tiến hành chuẩn độ dung dịch HCl a M ở 25oC sử dụng dung dịch sodium hydroxide (NaOH 0,10 M) làm chất chuẩn (Thí nghiệm 1). Sử dụng chỉ thị nitrazine vàng. Nitrazine vàng có màu vàng trong môi trường pH nhỏ hơn 6,0 hoặc màu xanh khi pH lớn hơn 7,0 .
Thêm 1 giọt chi thị nitrazine vàng vào bình tam giác chứa 100 mL dung dịch HCl mẫu. Cho đầu máy đo độ dẫn điện vào lòng dung dịch. Dung dịch NaOH được nhỏ từ từ vào dung dịch. Sau mỗi lần nhỏ, lắc đều dung dịch mẫu, ghi lại màu và độ dẫn điện của dung dịch. Kết quả được tổng hợp trong Hình 1.
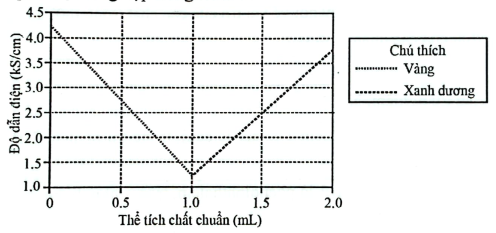
Hình 1. Kết quả chuẩn độ thí nghiệm 1
Trả lời cho các câu 1, 2, 3 dưới đây:
Trong phương pháp chuẩn độ acid - base, đại lượng nào được sử dụng để biểu thị khả năng dẫn điện của dung dịch?
Đáp án đúng là: D
Dựa vào thông tin văn bản xác định đơn vị, đại lượng độ dẫn điện.
Đáp án cần chọn là: D
Độ dẫn điện của dung dịch phụ thuộc vào nồng độ ion trong dung dịch. Nồng độ ion càng nhiều độ dẫn điện càng cao. Trong thí nghiệm chuẩn độ dung dịch HCl bằng dung dịch NaOH, tại sao độ dẫn điện của dung dịch giảm dần đến thể tích khoảng 1,0 mL NaOH, sau đó lại tăng lên?
Đáp án đúng là: A
Chuẩn độ acid-base là quá trình trung hòa ion H⁺ của acid bằng ion OH⁻ của base.
Độ dẫn điện phụ thuộc vào nồng độ và loại ion trong dung dịch: ion H⁺ và OH⁻ đều dẫn điện rất tốt.
Ban đầu dung dịch chứa chủ yếu ion H⁺ (từ HCl), khi thêm NaOH, các ion OH⁻ phản ứng với H⁺ tạo nước (không dẫn điện), nên tổng số ion giảm ⟶ độ dẫn điện giảm.
Khi vừa hết H⁺ (tại điểm tương đương), nếu tiếp tục thêm NaOH, dung dịch dư OH⁻ → nồng độ ion tăng lại → độ dẫn điện tăng lên.
Đáp án cần chọn là: A
Thực hiện lặp lặp lại lặp lại các thao tác trong thí nghiệm 1 để chuẩn độ dung dịch acetic acid (CH3COOH). Kết quả được tổng hợp trong Hình 2.
Phản ứng chuẩn độ: CH3COOH + NaOH ⟶ CH3COONa + H2O
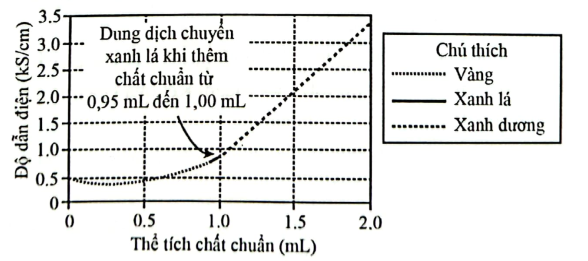
Hình 2. Tổng hợp kết quả chuẩn độ acetic acid
Trong thí nghiệm 2, dịch dịch cần chuẩn có nồng độ trong khoảng nào?
Đáp án đúng là: C
Điểm kết thúc chuẩn độ là điểm dung dịch đổi màu
Theo phương trình phản ứng: $\left. n_{CH_{3}COOH} = n_{NaOH}\Rightarrow C_{M(CH_{3}COOH)} = \dfrac{n_{CH_{3}COOH}}{V} \right.$
Đáp án cần chọn là: C
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











