Điện phân là quá trình tiến hành phản ứng dưới sự tác động
Điện phân là quá trình tiến hành phản ứng dưới sự tác động của dòng điện một chiều.
1. Hoàn thành hai phương trình phản ứng điện phân sau và nêu ứng dụng của mỗi phản ứng trong thực tế sản xuất công nghiệp.
a) $A{l_2}{O_3}\xrightarrow{{dpnc}} \ldots $
b) $NaCl + {H_2}O\xrightarrow{{dp\,cmn}} \ldots $
2. Hình bên mô tả một thiết bị phân hủy nước bằng dòng điện.
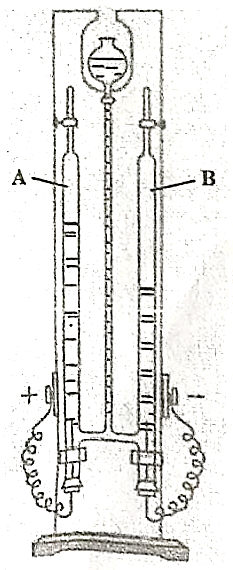
a) Viết phương trình phản ứng điện phân nước.
b) Ban đầu các ống $\mathbf{A}$ và $\mathbf{B}$ đều chứa đầy nước nhưng sau một thời gian dòng điện một chiều đi qua thì có các khí tích tụ. Xác định (có giải thích) khí hình thành trong ống $\mathbf{A}$ và $\mathbf{B}$.
c) Vì sao để quá trình điện phân nước diễn ra thuận lợi thường phải pha thêm một ít dung dịch H2SO4?
3. Phương pháp điện phân cũng được sử dụng để mạ kim loại (mạ điện). Ví dụ khi điện phân dung dịch $\text{CuSO}_{4}$ thì xảy ra phản ứng: $CuS{O_4} + {H_2}O\xrightarrow{{dp}}Cu + {H_2}S{O_4} + {O_2}$
a) Cân bằng phương trình hoá học của phản ứng trên.
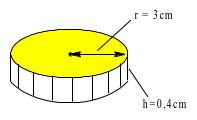
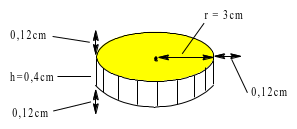
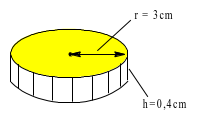
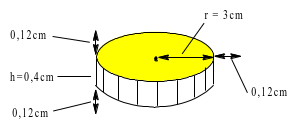
b) Trong quá trình sản xuất một loại huy chương, cần mạ một lớp đồng dày 1,2 mm đều lên khắp bề mặt lỗi thép hình trụ có bán kính đáy 3 cm và chiều cao 4 mm. Biết lớp đồng sinh ra bám lên lõi thép với tốc độ 0,12 gam/ giây; khối lượng riêng của đồng 8,98 gam/cm3. Tính thời gian cần thiết đề mạ một tấm huy chương như trên.
Quảng cáo
1. Phản ứng điện phân dung dịch
2. Các quá trình xảy ra trong bình điện phân:
Cathode: xảy ra quá trình khử
Anode: xảy ra quá trình oxi hoá
3.
Cân bằng phản ứng hoá học.
* Trước khi mạ : $\left\{ \begin{array}{l} {r = ~3\,\,(c\text{m})} \\ {h = 0,4\,\,(c\text{m})~} \end{array} \right.$ ⟹ Vtrước mạ = Sđáy.h = $\pi.r^{2}.h$
* Sau khi mạ: $\left\{ \begin{array}{l} {r = 3 + 0,12~ = 3,12\,\,(c\text{m})} \\ {h = 0,64\,\,(c\text{m})~} \end{array} \right.$ ⟹V sau mạ = $\pi.r^{2}.h$
⟹ m Cu cần mạ= $V.D$
⟹ Thời gian mạ kim loại = x = $\dfrac{74,2}{0,12} = 618,333$ giây
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com