GIẢN ĐỒ POURBAIX Giản đồ Pourbaix (còn gọi là giản đồ thế - pH) là một biểu
GIẢN ĐỒ POURBAIX
Giản đồ Pourbaix (còn gọi là giản đồ thế - pH) là một biểu đồ biểu diễn trạng thái nhiệt động học bền của một nguyên tố (thường là kim loại) trong dung dịch nước dưới dạng hàm số của thế điện cực (E) và độ pH. Giản đồ này được phát minh bởi nhà hóa học người Nga gốc Bỉ Marcel Pourbaix.
Trên giản đồ Pourbaix, các đường giới hạn chia mặt phẳng thành các vùng, mỗi vùng tương ứng với một dạng tồn tại bền của nguyên tố. Có ba loại đường giới hạn chính:
+ Đường nằm ngang: Biểu diễn các phản ứng oxi hóa - khử chỉ liên quan đến sự trao đổi electron mà không liên quan đến ion H+ (độc lập với pH).
+ Đường thẳng đứng: Biểu diễn các phản ứng acid - base hoặc thủy phân, có liên quan đến ion H+ (hoặc OH-) nhưng không có sự trao đổi electron (độc lập với thế E).
+ Đường xiên: Biểu diễn các phản ứng vừa có sự trao đổi electron, vừa có sự tham gia của ion H+. Thế điện cực của các phản ứng này phụ thuộc vào pH theo phương trình Nernst.
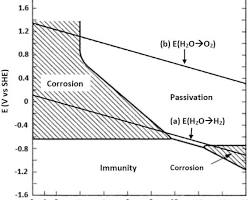
Giản đồ Pourbaix của quá trình điện phân H2O
Giản đồ Pourbaix cực kỳ hữu ích trong việc dự đoán khả năng ăn mòn kim loại. Về cơ bản, nó chia trạng thái của kim loại thành 3 vùng chính như hình minh họa dưới đây:
+ Vùng miễn dịch (Immunity): Kim loại bền ở dạng nguyên tố, không bị ăn mòn (thế điện cực thấp).
+ Vùng ăn mòn (Corrosion): Kim loại bị oxi hóa thành các ion tan (ví dụ Fe2+, Fe3+, …)
+ Vùng thụ động (Passivation): Kim loại được bao phủ bởi một lớp oxide hoặc hydroxide bền vững, ngăn cản quá trình ăn mòn tiếp diễn.
Trả lời cho các câu 1, 2, 3 dưới đây:
Dựa vào ngữ liệu trên, hãy cho biết trên giản đồ Pourbaix, loại đường nào biểu diễn cho các quá trình cân bằng acid - base (hoặc thủy phân) không kèm theo sự trao đổi electron?
Đáp án đúng là: B
Dựa vào thông tin ở đoạn văn bản.
Đáp án cần chọn là: B
Xét cân bằng của nước trên giản đồ Pourbaix, quá trình khử oxi hòa tan được biểu diễn bằng bán phản ứng: $\left. O_{2} + 4H^{+} + 4e^{-}\rightleftharpoons 2H_{2}O \right.$
Biết thế điện cực chuẩn E0 = 1,23V. Ở điều kiện chuẩn ($25^{{^\circ}}\text{C}$), sự phụ thuộc của thế điện cực E vào pH tuân theo phương trình: $E = E^{0} - 0,059 \cdot \text{pH}$.
Hãy tính giá trị thế điện cực E của phản ứng trên tại môi trường trung tính (pH = 7)
Đáp án đúng là: A
Áp dụng công thức $E = E^{0} - 0,059 \cdot \text{pH}$
Đáp án cần chọn là: A
Cho giản đồ Pourbaix của hệ Sắt - Nước (Fe – H2O) ở 250C dưới đây.
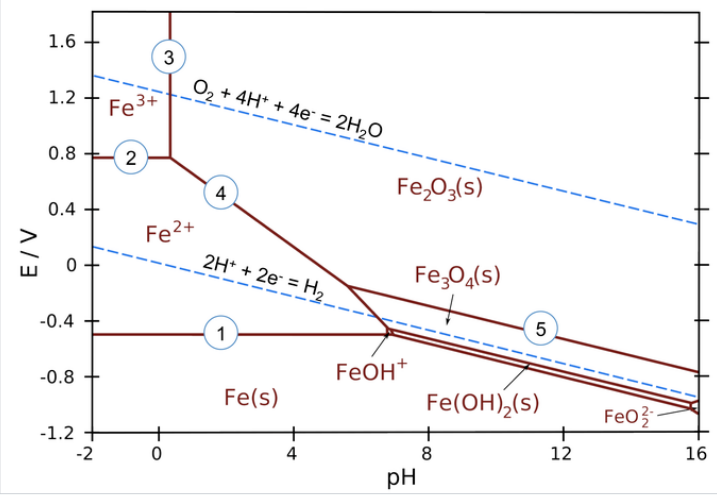
Phát biểu nào sau đây ĐÚNG?
Đáp án đúng là: A
Quan sát đồ thị kết hợp thông tin về các vùng của giản đồ Pourbaix.
Đáp án cần chọn là: A
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











