NaOH là chất rắn màu trắng, hút ẩm mạnh và tan tốt trong nước. Chính vì vậy để pha
NaOH là chất rắn màu trắng, hút ẩm mạnh và tan tốt trong nước. Chính vì vậy để pha được dung dịch NaOH có nồng độ chính xác từ hóa chất rắn thì sau khi pha chế người ta thường phải xác định lại nồng độ của dung dịch NaOH. Để xác định nồng độ của dung dịch NaOH có thể thực hiện chuẩn độ dung dịch bằng cách cho các thể tích khác nhau của dung dịch acid có nồng độ chính xác vào dung dịch NaOH và đo giá trị pH của dung dịch thu được. Một người thực hiện thí nghiệm pha dung dịch NaOH rồi chuẩn độ bằng dung dịch HCl theo các bước như sau:
Bước 1: Cân 2,0015 gam NaOH rắn bằng cân phân tích.
Bước 2: Đem lượng NaOH đó hòa tan hoàn toàn trong nước cất để tạo thành 1 lít dung dịch (dung dịch A).
Bước 3: Lấy chính xác 10,0 mL dung dịch A cho vào cốc thủy tinh 100,0 mL; cắm điện cực thủy tinh của máy đo pH (một dụng cụ đo giá trị pH của dung dịch) vào cốc; thêm chính xác các thể tích khác nhau của dung dịch HCl 0,05M; lắc đều dung dịch trong cốc và theo dõi pH của dung dịch.
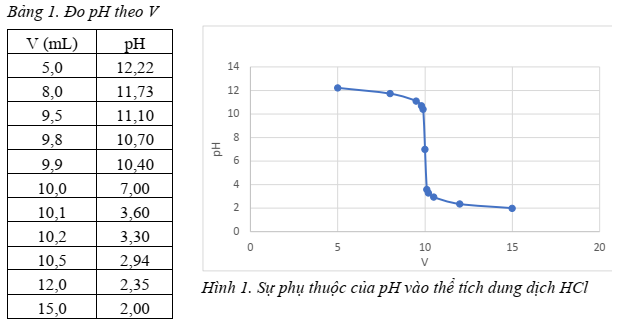
Giá trị pH đọc được tương ứng với các thể tích dung dịch HCl cho vào được thể hiện trong Bảng 1 và Hình 1.
Trả lời cho các câu 1, 2, 3 dưới đây:
Điền từ/cụm từ thích hợp vào chỗ trống.
Khi cân NaOH rắn thì thấy nếu kéo dài thời gian cân thì khối lượng đọc trên cân sẽ tăng dần sau đó không đổi là do NaOH …………
Đáp án đúng là: A
Dựa vào thông tin bài đọc, xác định tính chất hoá học của NaOH.
Đáp án cần chọn là: A
Thể tích dung dịch HCl 0,05M đã phản ứng vừa đủ với dung dịch NaOH trong thí nghiệm trên là
Đáp án đúng là: A
Phản ứng chuẩn độ: NaOH + HCl ⟶ NaCl + H2O
Theo phương trình phản ứng: $n_{NaOH} = n_{HCl}$
Tại điểm dừng chuẩn độ, lượng HCl và NaOH phản ứng vừa đủ với nhau ⟹ pH = 7
Đáp án cần chọn là: A
Khối lượng nước đã hấp thụ trong lượng NaOH rắn cân trong thí nghiệm là
Đáp án đúng là: A
Phản ứng chuẩn độ: NaOH + HCl ⟶ NaCl + H2O
Theo phương trình phản ứng: $\left. n_{NaOH} = n_{HCl}\Leftrightarrow C_{M(NaOH)}.V_{NaOH} = C_{M(HCl)}.V_{HCl} \right.$
⟹ nNaOH(trong 10mL) ⟹ nNaOH (trong 1 lít dung dịch)
⟹ mNaOH ⟹ mH2O
Đáp án cần chọn là: A
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











