4.1 Cho dung dịch X chứa AlCl3 và HCl. Chia dung dịch X thành hai phần bằng nhau: - Cho phần 1 tác
4.1 Cho dung dịch X chứa AlCl3 và HCl. Chia dung dịch X thành hai phần bằng nhau:
- Cho phần 1 tác dụng với dung dịch AgNO3 dư, thu được 71,75 gam kết tủa.
- Nhỏ từ từ dung dịch NaOH đến dư vào phần 2, lượng kết tủa thu được từ thí nghiệm được biểu diễn trên đồ thị sau:
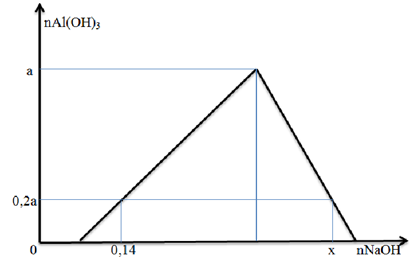
Các phản ứng xảy ra hoàn toàn. Xác định số mol AlCl3, số mol HCl trong dung dịch X và giá trị của x (trên đồ thị).
4.2 Cho 33,84 gam hỗn hợp X gồm Mg và Fe vào dung dịch chứa a mol Cu(NO3)2, khuấy đều, sau một thời gian, thu được dung dịch Y và 38,24 gam chất rắn Z. Cho Y tác dụng hết với lượng dư dung dịch NaOH, toàn bộ lượng kết tủa thu được đem nung trong không khí đến khối lượng không đổi, thấy còn lại 16 gam chất rắn khan. a) Xác định giá trị lớn nhất của a có thể đạt được. b) Trong trường hợp a có giá trị lớn nhất, nếu cho 19,12 gam chất Z phản ứng hết với axit H2SO4 đặc dư, thu được 10,752 lít khí SO2. Xác định khối lượng các chất có trong X. Cho rằng SO2 là sản phẩm khử duy nhất.
4.3 Điện phân (với điện cực trơ và có màng ngăn xốp) dung dịch chứa 0,05 mol CuSO4 và x mol KCl bằng dòng điện một chiều có cường độ 5A, sau một thời gian, thấy khối lượng dung dịch sau điện phân giảm 9,475 gam so với dung dịch ban đầu. Cho hết dung dịch thu được sau điện phân phản ứng với Al dư, phản ứng xong thấy thoát ra 1,68 lít khí H2 (đktc). Xác định x và tính thời gian (giây) đã điện phân. Cho rằng hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước.
Quảng cáo
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











