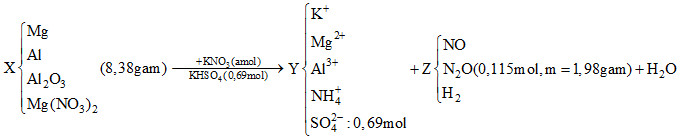
Hỗn hợp X gồm Mg, Al, Al2O3 và Mg(NO3)2. Cho 8,38 gam hỗn hợp X tác dụng với dung dịch hỗn hợp
Hỗn hợp X gồm Mg, Al, Al2O3 và Mg(NO3)2. Cho 8,38 gam hỗn hợp X tác dụng với dung dịch hỗn hợp chứa a mol KNO3 và 0,69 mol KHSO4 thu được dung dịch Y chỉ chứa các muối trung hoà; 2,576 lít hỗn hợp khí Z (đktc) gồm NO, N2O và H2 có tỉ khối so với hiđro là 198/23. Dung dịch Y tác dụng tối đa với dung dịch chứa 0,68 mol NaOH thu được 12,18 gam kết tủa và có 0,448 lít khí thoát ra ở điều kiện tiêu chuẩn. Phần trăm khối lượng Al trong hỗn hợp X là
Đáp án đúng là: B
Quảng cáo
Do Y tác dụng với dung dịch NaOH thu được khí nên Y chắc chắn có chứa NH4+.
Do hỗn hợp X tác dụng với dung dịch hỗn hợp KNO3 và KHSO4 thu được Y và hỗn hợp khí Z có chứa H2 nên trong dung dịch Y không còn ion NO3- (do tính oxi hóa của ion NO3- mạnh hơn H+).
Mà Y chỉ chứa các muối trung hòa nên thành phần dung dịch Y gồm K+, Mg2+, Al3+, NH4+, SO42-.
Sơ đồ phản ứng:
Khi cho Y tác dụng tối đa với dung dịch NaOH thì kết tủa cuối cùng thu được là Mg(OH)2 và khí thoát ra là khí NH3.
Từ khối lượng kết tủa (là Mg(OH)2) ta tính được số mol Mg2+ có trong dung dịch Y.
Từ thể tích khí thoát ra (là khí NH3) ta tính được số mol của ion NH4+ trong dung dịch Y.
Từ số mol NaOH phản ứng tối đa với dung dịch Y ta tính được số mol Al3+ có trong dung dịch Y.
Áp dụng định luật bảo toàn điện tích với dung dịch Y ta tính được số mol ion K+, từ đó suy ra nKNO3
Dùng định luật bảo toàn khối lượng ta tính được nH2O
Áp dụng bảo toàn nguyên tố H ta tìm được nH2
Từ đó tính được số mol của NO và N2O trong hỗn hợp khí Z.
Học sinh dựa vào các bán phản ứng để tính được số mol H+ phản ứng bằng
nH+ phản ứng = 6.nAl2O3 + 10.nNH4+ + 4.nNO + 10.nN2O + 2.nH2
Từ đó học sinh tính được số mol Al2O3 trong hỗn hợp X.
Dùng định luật bảo toàn nguyên tố Al ta tính được số mol Al trong hỗn hợp X
Từ đó tính được % khối lượng Al trong hỗn hợp X.
Đáp án cần chọn là: B
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











