Kim loại
Hòa tan hỗn hợp gồm 12,8 gam CuO và 16 gam Fe2O3 trong 155 ml dung dịch H2SO4 2M đến phản ứng xảy ra hoàn toàn. Sau phản ứng thấy có m gam chất rắn không tan. Tính m.
Đáp án đúng là: B
Quảng cáo
Đáp án cần chọn là: B
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com



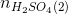 = 0,31 – 0,16 = 0,15 mol
= 0,31 – 0,16 = 0,15 mol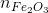 phản ứng =
phản ứng = 
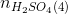 = 0,31 – 0,3 = 0,01 mol => nCuO(pư) = = 0,01 mol
= 0,31 – 0,3 = 0,01 mol => nCuO(pư) = = 0,01 mol







