Điện phân 400 ml dung dịch gồm NaCl; HCl và CuSO4 0,02M với điện cực trơ, màng ngăn xốp, cường
Điện phân 400 ml dung dịch gồm NaCl; HCl và CuSO4 0,02M với điện cực trơ, màng ngăn xốp, cường độ dòng điện là 1,93A. Coi thể tích dung dịch không thay đổi trong quá trình điện phân. Chỉ số pH theo thời gian được biểu diễn bằng đồ thị sau đây:
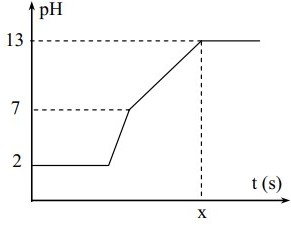
Giá trị của x trong hình vẽ là
Đáp án đúng là: D
Quảng cáo
Thứ tự điện phân trong dung dịch là:
Tại Anot (+): \(\mathop {2Cl}\limits^{ - 1} \to C{l_2} + 2{\rm{e}}\)
\(2{H_2}O \to \mathop {4H}\limits^{ + 1} + 4e + {O_2}\)
Tại Catot (-) có \(\mathop {Cu}\limits^{ + 2} + 2{\rm{e}} \to Cu\)
\(2\mathop H\limits^{ + 1} + 2e \to {H_2}\)
\(2{H_2}O + 2e \to 2O{H^ - } + {H_2}\)
Theo đồ thị ta thấy
+ Giai đoạn (1) đồ thị nằm ngang ⟹ điện phân Cu2+ ở (-) và Cl- ở (+)
+ Giai đoạn (2) đồ thị đi lên nhanh tạo dung dịch pH = 7 ⟹ điện phân H+ ở (-) và Cl- ở (+)
+ Giai đoạn (3) đồ thị đi lên tạo dung dịch mang tính bazơ ⟹ điện phân H2O ở (-) và Cl- ở (+)
+ Giai đoạn (4) đồ thị nằm ngang ⟹ chỉ có điện phân nước ở hai cực
-) Ban đầu pH = 2 ⟹ nH+= nHCl
-) Tại pH = 13 thì dung dịch thu được có OH- dư ⟹ khi đó dung dịch thu được có Na+, SO42- và OH-
⟹ nOH-
Bảo toàn điện tích ⟹ nNaCl ⟹ ne nhường tại thời điểm x giây ⟹ x
Đáp án cần chọn là: D
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











