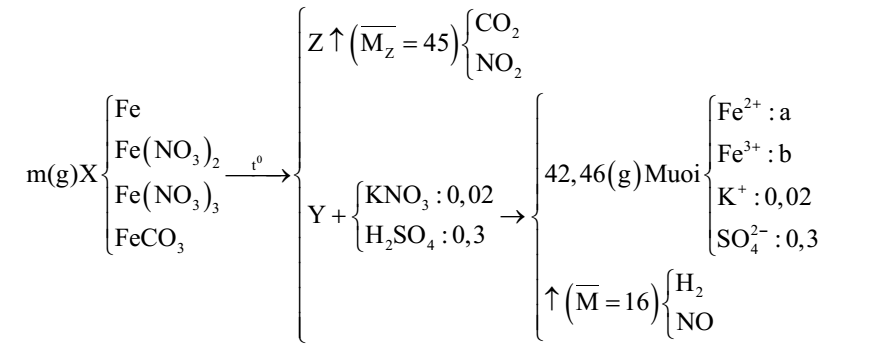
Nung m gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3 và FeCO3 trong bình kín (không có không khí). Sau khi các
Nung m gam hỗn hợp X gồm Fe, Fe(NO3)2, Fe(NO3)3 và FeCO3 trong bình kín (không có không khí). Sau khi các phản ứng xảy ra hoàn toàn, thu được chất rắn Y và khí Z có tỉ khối so với H2 là 22,5 (giả sử khí NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch gồm 0,02 mol KNO3 và 0,30 mol H2SO4 (loãng), thu được dung dịch chỉ chứa 42,46 gam muối trung hòa của kim loại và hỗn hợp hai khí có tỉ khối so với H2 là 8 (trong đó có một khí hóa nâu trong không khí). Giá trị của m là
Đáp án đúng là: B
Quảng cáo
- Biện luận
- Quy đổi
- Bảo toàn e, bảo toàn nguyên tố
Đáp án cần chọn là: B
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com