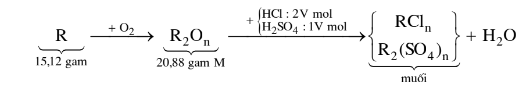Trả lời cho các câu 1, 2 dưới đây:
Để nghiên cứu tính chất của axit vô cơ X, người ta tiến hành các thí nghiệm như sau:
Thí nghiệm 1: Cho 1 ml dung dịch X đậm đặc vào ống nghiệm đựng 1 ml dung dịch bari clorua 0,1M thấy vẫn đục.
Thí nghiệm 2: Cho một mẫu kim loại đồng vào ống nghiệm chứa 2 ml dung dịch axit X đậm đặc, đun nóng thì thấy dung dịch chuyển sang màu xanh, có khí mùi hắc thoát ra.
Thí nghiệm 3: Cho một ít tinh thể hợp chất Y vào cốc thủy tinh, sau đó nhỏ từ từ 1 đến 2 ml dung dịch axit X đậm đặc vào cốc. Quan sát hiện tượng thấy: màu trắng của Y chuyển sang màu vàng, sau đó chuyển sang màu nâu và cuối cùng thành khối màu đen xốp, bị bọt khí đẩy lên miệng cốc.
a) Xác định các chất X, Y và viết các phương trình hóa học giải thích hiện tượng trong mỗi thí nghiệm trên.
b) Những thí nghiệm trên chứng minh tính chất gì của X ? Nếu thay dung dịch axit X đậm đặc bằng dung dịch axit X loãng thì hiện tượng các thí nghiệm trên có thay đổi không?
Dựa vào tính chất hóa học các chất.
Nung nóng 15,12 gam kim loại R trong không khí tới khi kim loại phản ứng hết thu được 20,88 gam oxit M. Hòa tan lượng oxit trên vào dung dịch chứa hỗn hợp HC1 2M và H2SO4 1M với lượng vừa đủ, các phản ứng không giải phóng chất khí.
a) Viết các phương trình hóa học phản ứng xảy ra. Tính thể tích dung dịch axit phải dùng và tổng số gam muối tạo thành.
b) Xác định kim loại R và công thức của oxit M.
Dựa vào tính chất hóa học các chất.
Quảng cáo
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com