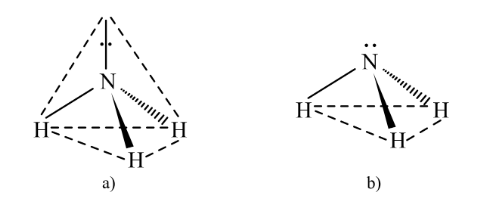
Mô hình lực đẩy giữa các cặp electron vỏ hoá trị - VSEPR (Valence Shell
Mô hình lực đẩy giữa các cặp electron vỏ hoá trị - VSEPR (Valence Shell Electron Pair Repulsion) có thể giúp ta dự đoán dạng hình học của phân tử (đặc trưng bởi cách sắp xếp của các nguyên tử trong không gian). Mô hình này dựa trên cơ sở các đám mây electron hoá trị của nguyên tử trung tâm sẽ đẩy nhau tới vị trí xa nhau nhất để lực đẩy giữa chúng là nhỏ nhất.
Chẳng hạn, nếu xung quanh nguyên tử trung tâm A có 2 đám mây electron hoá trị (kí hiệu là E ) thì do lực đẩy giữa 2 đám mây electron (cùng mang điện tích âm) nên 2 đám mây này phải có vị trí xa nhau nhất. Do vậy, vị trí hợp lí của A và 2 đám mây E phải có dạng thẳng, mà không phải là dạng góc.
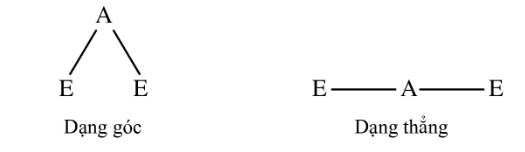
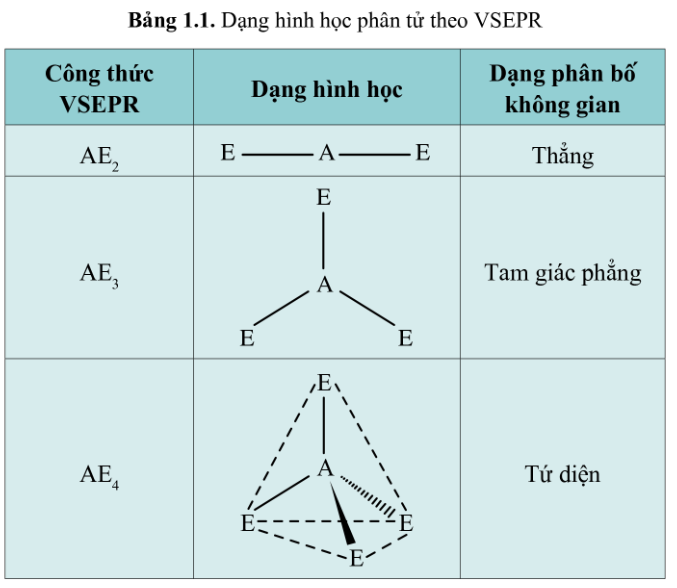
Vị trí phân bố các đám mây electron E xung quanh nguyên tử trung tâm A theo số lượng đám mây khác nhau được cho trong Bảng 1.1.
Như vậy, mô hình VSEPR có thể dự đoán được dạng hình học của phân tử
Trả lời cho các câu 1, 2, 3, 4 dưới đây:
Mô hình VSEPR được xây dựng dựa trên cơ sở nào?
Đáp án đúng là: C
Đọc và xử lí thông tin trong văn bản.
Hoặc cơ sở xây dựng mô hình lực đẩy giữa các cặp electron vỏ hóa trị.
Đáp án cần chọn là: C
Carbon dioxide có công thức Lewis là:
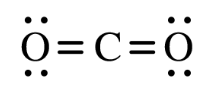
Theo mô hình VSEPR, carbon dioxide có dạng phân bố không gian là hình gì?
Đáp án đúng là: A
Xác định số đám mấy electron hóa trị xung quanh nguyên tử trung tâm (C) ⟹ Công thức VSEPR tương đương ⟹ Dạng hình học
Đáp án cần chọn là: A
Trong phân tử ammonia (NH3), nguyên tử trung tâm N có 3 liên kết đơn xung quanh và 1 cặp electron hóa trị riêng chưa tham gia liên kết, nên công thức VSEPR của NH3 là AE3 và phân tử này có dạng hình học tam giác phẳng.
Đáp án đúng là: B
Đọc thông tin bài đọc.
Số đám mây electron phân bố xung quanh nguyên tử trung tâm = Số đám mấy electron tham gia liên kết + Số đám mây electron hóa trị riêng.
⟹ Công thức VSEPR và dạng hình học phân tử.
Đáp án cần chọn là: B
Cho biết các phát biểu sau về mô hình VSEPR đúng hay sai?
| Đúng | Sai | |
|---|---|---|
| a) Một đám mây electron hóa trị có thể là một liên kết (đơn, đôi, ba), một cặp electron hóa trị riêng hoặc một electron độc thân. | ||
| b) Đám mây electron hóa trị trong công thức VSEPR được kí hiệu là A. | ||
| c) Mô hình VSEPR giúp dự đoán dạng hình học phân tử, giúp chúng ta có thêm những hiểu biết về khả năng phản ứng, phân cực của phân tử. | ||
| d) Vận dụng mô hình VSEPR cho thấy, dạng phân bố không gian của phân tử AE6 là bát diện. |
Đáp án đúng là: Đ; S; Đ; Đ
a) Khái niệm một đám mây electron hóa trị.
b) Ý nghĩa các kí hiệu trong công thức VSEPR.
c) Vai trò của mô hình VSEPR.
d) Liên hệ giữa hóa học và toán học
Đáp án cần chọn là: Đ; S; Đ; Đ
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com