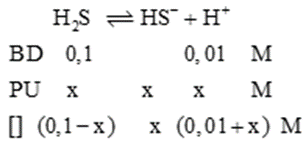Khi hòa tan các chất có liên kết ion hoặc liên kết cộng hóa trị
Khi hòa tan các chất có liên kết ion hoặc liên kết cộng hóa trị có cực vào trong dung môi phân cực (ví dụ như nước, rượu,…) thì do sự tương tác với các phân tử lưỡng cực của dung môi mà các phân tử chất tan sẽ phân li hoàn toàn hoặc một phần thành các ion mang điện tích trái dấu, tồn tại dưới dạng ion solvat hóa (đối với dung môi ion nước là ion hydrate hóa). Như vậy các chất có khả năng phân li thành các ion được gọi là chất điện li, và quá trình phân li thành ion được gọi là quá trình điện li.
Ví dụ khi hòa tan chất điện li \(MX\) vào nước:
![]()
Thông thường ta không biết chính xác số phân tử nước \(x,y\) trong ion hydrate hóa nên người ta biểu diễn sự phân li theo sơ đồ đơn giản: MX ⇌ Mn+ + Xn- (1) , với ngầm hiểu là \({M^{n + }},{X^{n - }}\) chỉ là các ion hydrate hóa.
Mức độ phân li thành ion của các chất điện li phụ thuộc vào bản chất của các chất điện li và bản chất của dung môi. Ví dụ: \(HCl\) trong nước là chất điện li mạnh, còn \(C{H_3}COOH\) lại là chất điện li yếu. Để đặc trưng định lượng sự phân li của các chất điện li, người ta dựa vào độ điện li α và hằng số điện li \(K\).
Độ điện li α là tỉ số mol \(n\) của chất đã phân li thành ion với tổng số mol \({n_0}\) của chất tan trong dung dịch:
\(\alpha = \dfrac{n}{{{n_0}}}(*)\)
Nếu chia cả hai số hạng của biểu thức (*) cho thể tích \(V\) của dung dịch thì:
\(\alpha = \) Nồng độ chất đã điện li / Tổng nồng độ chất đã điện li
\(\alpha \) sẽ có các giá trị dao động từ 0 đến 1: \(0 \le \alpha \le 1\)
\(\alpha = 0\) đối với chất không điện li;
\(\alpha = 1\) đối với chất điện li hoàn toàn.
Áp dụng định luật tác dụng khối lượng cho cân bằng (1), ta có: \({K^C} = \dfrac{{[{M^{n + }}][{X^{n - }}]}}{{[MX]}}\)
Ở đât \([i]\) chỉ nồng độ của cấu tử \(i\) trong dung dịch ở trạng thái cân bằng.
\({K^C}\) là hằng số điện li nồng độ, phụ thuộc vào bản chất của chất li, vào dung môi, vào nhiệt độ, Trong dung dịch loãng, \({K^C}\) không phụ thuộc vào nồng độ chất điện li.
Trả lời cho các câu 1, 2, 3, 4, 5, 6, 7 dưới đây:
Nhận định nào dưới đây là không chính xác?
Đáp án đúng là: C
Dựa vào đoạn thông tin mô tả về quá trình điện li, chất điện li và kiến thức thực tế.
Đáp án cần chọn là: C
Biểu thức nào dưới đây là đặc trưng định lượng cho sự phân li của ion \({M^{n + }}\) trong nước ở trạng thái cân bằng?
Đáp án đúng là: A
- Dựa vào 2 đoạn thông tin:
Đoạn 1: Độ điện li α là tỉ số mol \(n\) của chất đã phân li thành ion với tổng số mol \({n_0}\) của chất tan trong dung dịch:
\(\alpha = \dfrac{n}{{{n_0}}}(*)\)
Nếu chia cả hai số hạng của biểu thức (*) cho thể tích \(V\) của dung dịch thì:
\(\alpha = \) Nồng độ chất đã điện li / Tổng nồng độ chất đã điện li
Đoạn 2: Áp dụng định luật tác dụng khối lượng cho cân bằng (1), ta có: \({K^C} = \dfrac{{[{M^{n + }}][{X^{n - }}]}}{{[MX]}}\)
Ở đât \([i]\) chỉ nồng độ của cấu tử \(i\) trong dung dịch ở trạng thái cân bằng.
Đáp án cần chọn là: A
Điền từ không quá 1 tiếng để hoàn thành nhận định sau?
Nồng độ chất đã phân li bằng ______ nồng độ chất điện li với độ điện li.
Đáp án đúng là: tích
Dựa vào biểu thức về độ điện li α.
Đáp án cần điền là: tích
Kéo thả cụm từ thích hợp vào chỗ trống?
Trong trường hợp chất \(MX\) phân li cực ít trong nước (\(\alpha < < 1\)), biểu thức liên hệ giữa hằng số phân li, độ điện li và nồng độ của chất điện li ban đầu là: \(\alpha = \sqrt {\dfrac{{{K^C}}}{C}} \). Hoàn thành các nhận định dưới đây
- Độ điện li với hằng số phân li \(K\). Nếu hằng số phân li càng thì chất điện li càng mạnh, phân li càng nhiều.
- Độ điện li với nồng độ. Đối với một chất nhất định (\(K\) không đổi) thì trong dung dịch càng loãng, chất điện li càng nhiều.
Đáp án đúng là: tỉ lệ thuận; lớn ; tỉ lệ nghịch
Theo biểu thức liên hệ giữa hằng số phân li, độ điện li và nồng độ của chất điện li ban đầu là: \(\alpha = \sqrt {\dfrac{{{K^C}}}{C}} \), độ điện li tỉ lệ thuận với hằng số phân li và tỉ lệ nghịch với nồng độ của chất điện li.
Đáp án cần chọn là: tỉ lệ thuận; lớn ; tỉ lệ nghịch
Dựa vào dữ liệu trong các câu trên để giải quyết bài tập sau
Trong dung dịch \(C{H_3}COOH\,\,1,00M\), tỉ lệ acid ion hóa là 0,417%. Thông qua tính toán thấy hằng số phân li của acetic acid trong điều kiện này \(a{.10^{ - 4}}\). Giá trị của \(a\) là ________. (Làm tròn kết quả đến số thập phân thứ hai).
Đáp án đúng là: 17,39
Theo đầu bài tỉ lệ acid ion hóa là 0,417% ⇒ \({\alpha _{C{H_3}COOH}} = 0,00417 < < 1\) nên có thể tính toán hằng số phân li của acetic acid theo biểu thức \(\alpha = \sqrt {\dfrac{{{K^C}}}{C}} \).
Đáp án cần điền là: 17,39
Trong dung dịch acetic acid, có thể có
Đáp án đúng là: A; B; C; D
Acetic acid là một acid yếu nên trong dung dịch phân li theo mũi tên hai chiều.
Đáp án cần chọn là: A; B; C; D
Tính pH của hệ là hỗn hợp của HCl 0,01M và H2S 0,1M, biết Ka1 (H2S) = 10-7,02 (Ka1 là hằng số phân li acid nấc thứ nhất) và bỏ qua nấc phân li thứ hai của acid H2S. (Điền kết quả đến số thập phân thứ hai).
Đáp án đúng là: 1,99
Công thức tính pH là \(pH = - \lg [{H^ + }]\).
Đáp án cần điền là: 1,99
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com