Trong tự nhiên, các quá trình tự diễn biến xảy ra theo xu hướng: làm
Trong tự nhiên, các quá trình tự diễn biến xảy ra theo xu hướng: làm giảm năng lượng hóa học - enthalpy (\(\Delta H < 0\)) và làm tăng độ mất trật tự của hệ - entropy (\(\Delta S > 0\)). Khi xét đến quá trình hóa học có tự xảy ra hay không phải xét đồng thời cả biến thiên enthalpy và biến thiên entropy, thông qua biến thiên năng lượng Gibbs (\(\Delta G\)) (ở nhiệt độ và áp suất không đổi): \({\Delta _r}G_T^o = {\Delta _r}H_T^o - T.{\Delta _r}S_T^o\).
Trong đó:
\({\Delta _r}H_T^o\,(kJ/mol)\) là biến thiên enthalpy chuẩn của phản ứng ở nhiệt độ T, bằng tổng nhiệt tạo thành chuẩn của các chất sản phẩm trừ đi tổng nhiệt tạo thành của các chất tham gia. Phản ứng tỏa nhiệt thì \({\Delta _r}H^\circ \) có giá trị âm còn phản ứng thu nhiệt thì \({\Delta _r}H^\circ \) có giá trị dương.
\({\Delta _r}S_T^o\,(J/mol.K)\) là biến thiên entropy chuẩn của phản ứng ở nhiệt độ T, bằng tổng entropy chuẩn của các chất sản phẩm trừ đi tổng entropy của các chất tham gia;
\(T\) là nhiệt độ tại đó xảy ra phản ứng (theo thang Kelvin);
\({\Delta _r}G_T^o\) là biến thiên năng lượng tự do Gibbs chuẩn của phản ứng ở nhiệt độ \(T\).
Dựa vào \({\Delta _r}G_T^o\) có thể dự đoán hoặc giải thích được chiều hướng của một phản ứng hóa học ở nhiệt độ \(T\):
\({\Delta _r}G_T^o < 0\) phản ứng sẽ tự xảy ra, giá trị \({\Delta _r}G_T^o\) càng âm, phản ứng càng dễ xảy ra;
\({\Delta _r}G_T^o = 0\) phản ứng đạt trạng thái cân bằng;
\({\Delta _r}G_T^o > 0\) phản ứng không tự xảy ra.
Trả lời cho các câu 1, 2, 3, 4, 5, 6 dưới đây:
Kéo thả cụm từ thích hợp vào chỗ trống
Để một phản ứng không tự xảy ra ở mọi nhiệt độ thì biến thiên enthalpy của phản ứng đó0 và biến thiên entropy của phản ứng đó0.
Đáp án đúng là: lớn hơn; nhỏ hơn
Biến đổi biểu thức \({\Delta _r}G_T^o = {\Delta _r}H_T^o - T.{\Delta _r}S_T^o\) để rút ra giá trị của biến thiên enthalpy và biến thiên entropy của phản ứng so với 0.
Đáp án cần chọn là: lớn hơn; nhỏ hơn
Các nhận định sau là đúng hay sai?
| Đúng | Sai | |
|---|---|---|
| a) Phản ứng tỏa nhiệt luôn có khả năng tự xảy ra.\(\) | ||
| b) Có thể kết luận ngay là phản ứng không tự xảy ra khi \({\Delta _r}G_T^o\) của phản ứng dương tại điều kiện đang xét. | ||
| c) Có thể căn cứ vào hiệu ứng nhiệt để dự đoán khả năng tự phát của phản ứng ở nhiệt độ thường. | ||
| d) Ở ≈ 1000K, khả năng tự phát của phản ứng hóa học chủ yếu chỉ phụ thuộc vào giá trị biến thiên enthalpy. |
Đáp án đúng là: S; Đ; S; S
Biến đổi biểu thức \({\Delta _r}G_T^o = {\Delta _r}H_T^o - T.{\Delta _r}S_T^o\) để rút ra giá trị của biến thiên enthalpy và biến thiên entropy của phản ứng tại các điều kiện ứng với từng nhận định.
Đáp án cần chọn là: S; Đ; S; S
Nhận định nào dưới đây là chính xác?
Phản ứng thu nhiệt mạnh
Đáp án đúng là: D
- Phản ứng thu nhiệt mạnh: \({\Delta _r}H_T^o > 0\) (biến thiên enthalpy dương).
- Điều kiện tự phát: \({\Delta _r}G_T^o < 0\) (biến thiên năng lượng tự do Gibbs âm).
- Công thức Gibbs: \({\Delta _r}G_T^o = {\Delta _r}H_T^o - T.{\Delta _r}S_T^o\). Phản ứng thu nhiệt mạnh là phản ứng có biến thiên enthalpy nhỏ hơn 0 và rất âm.
Đáp án cần chọn là: D
Chọn các đáp án đúng
Một phản ứng có thể tự xảy ra khi
Đáp án đúng là: A; C; D
- Điều kiện tự phát: \({\Delta _r}G_T^o < 0\) (biến thiên năng lượng tự do Gibbs âm).
- Công thức Gibbs: \({\Delta _r}G_T^o = {\Delta _r}H_T^o - T.{\Delta _r}S_T^o\). Phản ứng thu nhiệt mạnh là phản ứng có biến thiên enthalpy nhỏ hơn 0 và rất âm.
Đáp án cần chọn là: A; C; D
Điền từ không quá một tiếng và số nguyên thích hợp vào chỗ trống
Biến thiên enthalpy và entropy của phản ứng \(2S{O_2}\left( g \right) + {O_2}\left( g \right) \to 2S{O_3}\left( g \right)\)ở 25oC lần lượt là \({\Delta _r}{H^o} = - 198{\rm{ }}kJ\)và \({\Delta _r}{S^o} = - 187{\rm{ }}J/K\).
- Khi tăng nhiệt độ, giá trị của \({\Delta _r}{G^o}\) .
- Tại khoảng nhiệt độ lớn hơn K thì phản ứng tự xảy ra.
Đáp án đúng là: tăng; 1059
Công thức Gibbs: \({\Delta _r}G_T^o = {\Delta _r}H_T^o - T.{\Delta _r}S_T^o\). Phản ứng thu nhiệt mạnh là phản ứng có biến thiên enthalpy nhỏ hơn 0 và rất âm.
Đáp án cần điền là: tăng; 1059
Xét phản ứng sau: \(CaC{O_3}\left( s \right) \to CaO\left( s \right) + C{O_2}\left( g \right)\). Giả sử giá trị enthalpy và entropy của phản ứng không thay đổi theo nhiệt độ. Mối liên hệ giữa \({\Delta _r}G^\circ \)và T (K) của phản ứng trên như sau:
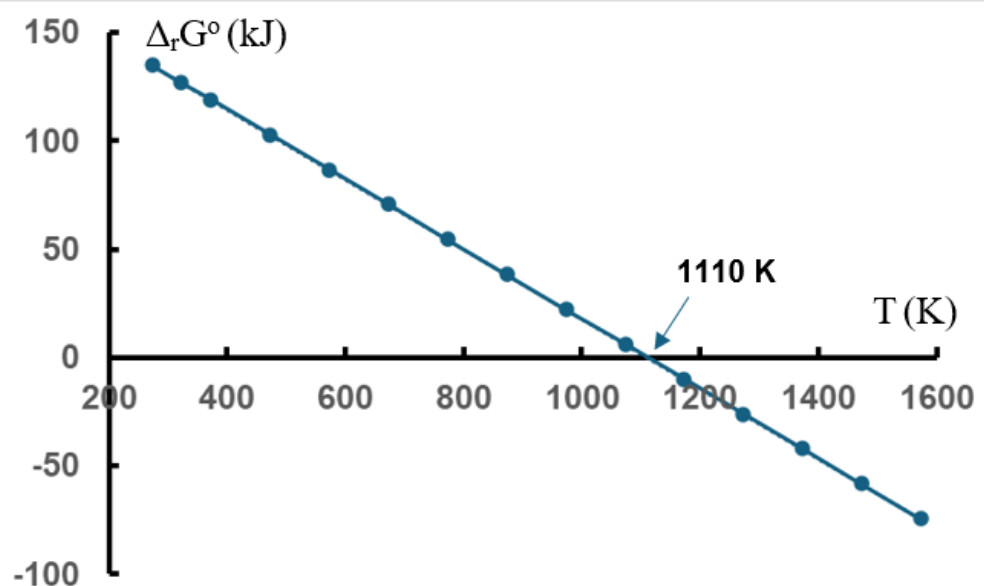
Hãy chọn nhận xét sai
Đáp án đúng là: D
Dựa vào biểu đồ và mối quan hệ giữa các đại lượng trong biểu thức tính biến thiên năng lượng Gibbs.
Đáp án cần chọn là: D
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











