Để phản ứng hoá học xảy ra, các phân tử cần va chạm hiệu quả với nhau.
Để phản ứng hoá học xảy ra, các phân tử cần va chạm hiệu quả với nhau. Điều này đòi hỏi các phân tử chuyển động đủ nhanh, nghĩa là phải có động năng đủ lớn. Để làm tăng số lượng va chạm hiệu quả, các phân tử cần được cung cấp năng lượng thường là dưới dạng nhiệt năng. Điều này giải thích vì sao người ta thường dùng đèn cồn, bếp điện để đun nóng hỗn hợp phản ứng khi làm thí nghiệm cũng như cần phải đốt nóng hoặc gia nhiệt trong công nghiệp sản xuất hoá chất.
Năng lượng hoạt hoá (kí hiệu là Ea) là năng lượng tối thiểu mà các chất tham gia cần phải có thể phản ứng có thế xảy ra. Với một cùng một phản ứng, Ea càng nhỏ thì tốc độ phản ứng càng cao do có nhiều nguyên tử hoặc phân tử đạt tới năng lượng này, tức là có nhiều va chạm hiệu quả xảy ra.
Phương trình Arrhenius giúp ta có thể tính được sự thay đổi của hằng số tốc độ phản ứng k theo năng lượng hoạt hoá Ea (J.mol-1) và nhiệt độ T (Kelvin). Hằng số tốc độ k tăng (giảm) bao nhiêu lần thì tốc độ phản ứng cũng tăng (giảm) bấy nhiêu lần.
$k = A.e^{\dfrac{- E_{a}}{RT}}$
Trong đó:
A là một hằng số cho một số phản ứng xác định.
R là hằng số khí R = 8,314 J.K-1 mol-1
Trả lời cho các câu 1, 2, 3 dưới đây:
Để phản ứng hoá học xảy ra thì
Đáp án đúng là: A
Căn cứ vào dữ liệu đoạn văn.
Đáp án cần chọn là: A
Hình dưới biểu diễn cùng một phản ứng nhưng năng lượng hoạt hoá khác nhau. Phản ứng này thuận lợi về năng lượng.
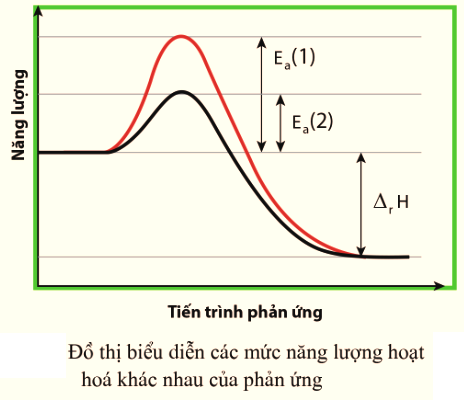
Phát biểu nào dưới đây là sai?
Đáp án đúng là: D
Căn cứ vào dữ liệu đoạn văn.
Đáp án cần chọn là: D
Phản ứng tổng hợp SO3 trong dây chuyền sản xuất sulfuric acid:
2SO2 (g) + O2 (g) ⟶ 2SO3 (g)
Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ từ 3500C lên 4500C? Biết năng lượng hoạt hóa của phản ứng là 314 kJ/mol.
Đáp án đúng là: A
\({k_1} = A.{e^{\dfrac{{ - {E_a}}}{{R{T_1} & }}}}\), \({k_2} = A.{e^{\dfrac{{ - {E_a}}}{{R{T_2}}}}}\)
Chia k2 cho k1 ⟹ Mối liên hệ giữa k1 và k2
\(\dfrac{{{k_2}}}{{{k_1}}} = {e^{\dfrac{{{E_a}}}{{R.{T_1}}} - \dfrac{{{E_a}}}{{R.{T_2}}}}}\)
⟹ Mối liên hệ của tốc độ phản ứng trước và sau khi tăng nhiệt độ.
Hằng số tốc độ k tăng (giảm) báo nhiêu lần thì tốc độ phản ứng cũng tăng (giảm) bấy nhiêu lần.
Đáp án cần chọn là: A
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











