(1,0 điểm)1. Cho các ống nghiệm đựng riêng rẽ các dung dịch: NaCl, AlCl3, Al2(SO4)3, NH4Cl,
(1,0 điểm)
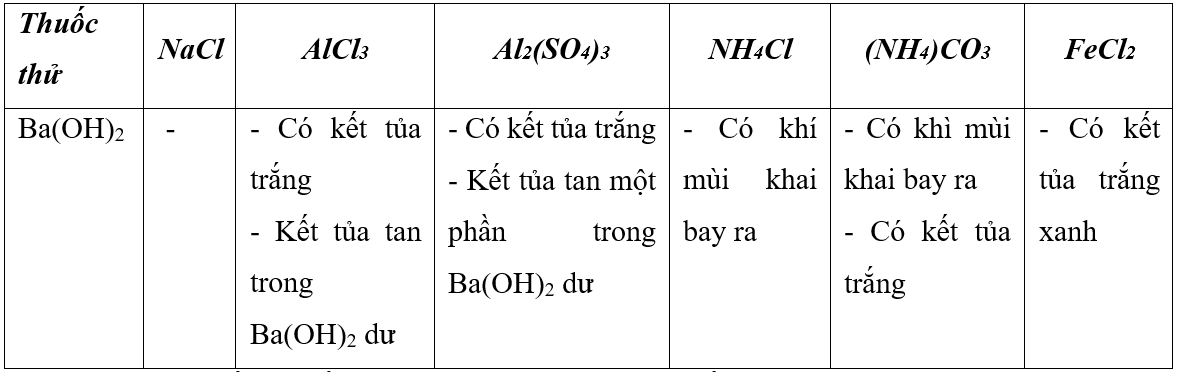
1. Cho các ống nghiệm đựng riêng rẽ các dung dịch: NaCl, AlCl3, Al2(SO4)3, NH4Cl, (NH4)2CO3, FeCl2. Chỉ dùng một thuốc thử, hãy trình bày cách nhận biết các dung dịch trên và viết phương trình hóa học của các phản ứng xảy ra.
2. Giải thích các hiện tượng hoặc vấn đề sau và viết phương trình hóa học của các phản ứng xảy ra:
a) Để giảm thiểu hiệu ứng nhà kính của bầu khí quyển trên trái đất, chúng ta nên trồng thêm nhiều cây xanh, hạn chế sử dụng các nhiên liệu hóa thạch như than đá (thành phần chủ yếu là carbon), xăng đầu (thành phần chủ yếu là các hydrocarbon).
b) Vì sao muối NaHCO3 được dùng để chế thuốc giảm đau dạ dày.
Quảng cáo
1. Tính chất hoá học muối.
Sử dụng hoá chất có hiện tượng phản ứng khác nhau (kết tủa, màu sắc kết tủa, khí)
2. Tính chất hoá học oxide acid.
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com