Đốt cháy hết 1,44 gam cacbon trong bình kín chứa 1,792 lít O2 (đktc), thu được hỗn hợp khí T.
Đốt cháy hết 1,44 gam cacbon trong bình kín chứa 1,792 lít O2 (đktc), thu được hỗn hợp khí T. Dẫn toàn bộ T vào ống sứ nung nóng chứa 10,4 gam hỗn hợp rắn X gồm MgCO3, Zn và Fe3O4 (trong đó oxi chiếm 23,077% về khối lượng), thu được hỗn hợp rắn Y và 2,912 lít khí duy nhất (đktc). Hòa tan toàn bộ Y trong dung dịch HNO3 (dư), thu được 0,026 mol NO và 0,014 mol N2O. Biết các phản ứng xảy ra hoàn toàn. Số mol HNO3 tham gia phản ứng có giá trị gần nhất với giá trị nào sau đây?
Đáp án đúng là: A
Quảng cáo
Từ phản ứng đốt cháy cacbon tính được số mol của CO và CO2 trong hỗn hợp T.
Sơ đồ phản ứng:
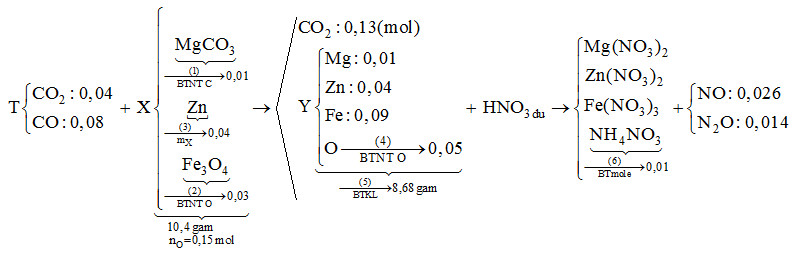
Dẫn toàn bộ T vào ống sứ nung nóng chứa chất rắn X gồm MgCO3, Zn và Fe3O4 thu được hỗn hợp rắn Y và 2,912 lít khí duy nhất (đktc). Vậy khí duy nhất là khí CO2 → nCO2 = 0,13 (mol)
Bảo toàn nguyên tố C tính được số mol MgCO3 trong hỗn hợp X.
Từ % khối lượng oxi trong X tính được số mol O trong X, từ đó tính được số mol Fe3O4.
Từ khối lượng chất rắn X ta tính được số mol Zn.
Bảo toàn nguyên tố O ta có: nO (Y) = nO (T) + nO (X) - 2nCO2
Quy đổi hỗn hợp Y thành Mg, Zn, Fe và O.
Hòa tan toàn bộ Y trong dung dịch HNO3 (dư), thu được dung dịch chứa Mg(NO3)2, Zn(NO3)2, Fe(NO3)3, có thể có NH4NO3.
Áp dụng định luật bảo toàn electron ta tính được số mol NH4NO3.
Số mol HNO3 đã phản ứng được tính bằng biểu thức nHNO3 (pư) = 4.nNO + 10.nN2O + 10.nNH4NO3 + 2.nO
Đáp án cần chọn là: A
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











