Thực tập sinh X tiến hành thí nghiệm điện phân sau: Điện phân 100 ml dung dịch chứa FeCl3 aM và
Thực tập sinh X tiến hành thí nghiệm điện phân sau: Điện phân 100 ml dung dịch chứa FeCl3 aM và CuSO4 bM với điện cực trơ, không màng ngăn, cường độ dòng điện là 7,72 Ampe trong thời gian 20 phút thì ngắt dòng điện. X đo được thể tích khí thu được bên anot là 0,7056 lít (đktc). Sau đó, do sơ suất, thực tập X cắm ngược chiều cực của nguồn điện vào hai điện cực của bình điện phân, điện phân thêm 30 phút nữa với cường độ dòng không đổi thì thể tích khí thu được ở cả hai điện cực là 0,8176 lít (đktc). Giá trị của b là:
Đáp án đúng là: C
Quảng cáo
Xét trong 20 phút đầu. Số mol electron trao đổi là: \({n_{e\,trao\,doi1}} = \frac{{I.t}}{F} = \frac{{7,72.20.60}}{{96500}} = 0,096\,(mol)\)
Số mol khí thu được bên anot: \(n{\,_{khi(dktc)}} = \frac{V}{{22,4}} = \frac{{0,7056}}{{22,4}} = 0,0315\,(mol)\)
Đặt số mol Cl2 = a (mol) và số mol O2 = b (mol)
Ta có hệ phương trình: \(\left\{ \begin{array}{l}n{\,_{khi\,anot}} = a + b = 0,0315\\{n_{e\,trao\,doi}}_1 = 2a + 4b = 0,096\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = ? = {n_{C{l_2}}}\\b = ? = {n_{{O_2}}}\end{array} \right.\)
BTNT “Cl”: nFeCl3 = 1/3nCl- = 2/3nCl2 = ? (mol)
Xét trong 30 phút tiếp theo: Số mol electron trao đổi là: \({n_{e\,trao\,doi2}} = \frac{{I.t}}{F} = \frac{{7,72.30.60}}{{96500}} = 0,144\,(mol)\)
Số mol khí thu được hai bên : \(n{\,_{khi(dktc)}} = \frac{V}{{22,4}} = \frac{{0,8176}}{{22,4}} = 0,0365\,(mol)\)
Nếu trong 20 phút đầu tiên Cu2+ đã điện phân hết thì 30 phút tiếp theo chỉ có H2 thoát ra bên catot và O2 thoát ra bên anot.
\( \Rightarrow \left\{ \begin{array}{l}{n_{{H_2}(catot)}} = \frac{{ne\,trao\,doi\,2}}{2} = ?\,(mol)\\{n_{{O_2}(anot)}} = \frac{{ne\,trao\,doi\,2}}{4} = ?\,(mol)\end{array} \right.\) → kết luận được vô lí
Do đó trong 20 phút đầu Cu2+ chưa điện phân hết, Cu2+ tiếp tục bị điện phân ở 30 phút tiếp theo
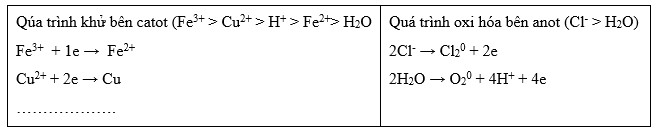
Sử dụng bảo toàn e, chú ý có hiện tượng dương cực tan.
Đáp án cần chọn là: C
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com