Trả lời cho các câu 1, 2, 3 dưới đây:
A1 và A2 là hợp chất của Na, trong phân tử chỉ chứa hai nguyên tố và đều có hàm lượng Na là 58,97% theo khối lượng. A1 là chất khử mạnh còn A2 là chất oxi hóa mạnh. Al phản ứng với dung dịch KMnO4 trong H2SO4 loãng tạo nên chất rắn màu vàng nhạt B1. Phản ứng tương tự của A2 với KMnO4 tạo nên khí không màu B2. Biết B1 và B2 là đơn chất của hai nguyên tố cùng nhóm trong bảng tuần hoàn các nguyên tố hóa học.
a) Xác định A1, A2. B1, B2 và viết các phương trình phản ứng.
b) Tìm các chất từ C1 đến C5 và D1 đến 4 trong sơ đồ chuyển hóa sau. (Không cần viết phương trình phản ứng)
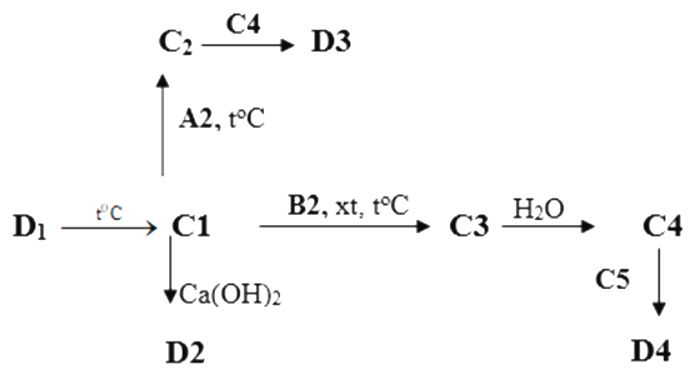
Cho biết các hợp chất từ D1, D2, D3 và D4 đều có 1 nguyên tử S trong công thức hóa học và đều có hàm lượng S là 26,67% theo khối lượng.
Dựa vào tính chất hóa học của các chất.
Cho 12,8 gam bột lưu huỳnh phản ứng với 41,4 gam K2CO3 ở nhiệt độ cao thu được 6,72 là khí E1 (đktc) và hỗn hợp rắn X chỉ gồm hai muối E2 và E3. Biết muối E2 và nguyên tố kali lần lượt chiếm 53,66% và 57,07% khối lượng của X. Muối E2 tạo thành tử hai nguyên tố. Khối lượng mol của E3 nhỏ hơn 200g/mol. Xác định E1, E2, E3 và viết phương trình phản ứng xảy ra.
Thêm từ từ dụng dịch Y chứa AlCl3 0,3 M và HCl 0,2 M vào 100 ml dung dịch NaOH. Tính thể tích dung dịch Y trong các trường hợp sau:
a) Kết tủa trắng bắt đầu xuất hiện.
b) Lượng kết tủa trắng làm nhất.
c) Sau khi phản ứng kết thúc, thu được 1,638 gam kết tủa.
Dựa vào bài toán muối nhôm phản ứng với dung dịch kiềm, axit.
Quảng cáo
>> Học trực tuyến lớp 9 và Lộ trình UP10 trên Tuyensinh247.com Đầy đủ khoá học các bộ sách: Kết nối tri thức với cuộc sống; Chân trời sáng tạo; Cánh diều. Lộ trình học tập 3 giai đoạn: Học nền tảng lớp 9, Ôn thi vào lớp 10, Luyện Đề. Bứt phá điểm lớp 9, thi vào lớp 10 kết quả cao. Hoàn trả học phí nếu học không hiệu quả. PH/HS tham khảo chi tiết khoá học tại: Link
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











