SẢN PHẨM PHỤ SINH RA KHI CHO NaClO phản ứng với NH3 Mọi người sử dụng nhiều loại hóa
SẢN PHẨM PHỤ SINH RA KHI CHO NaClO phản ứng với NH3
Mọi người sử dụng nhiều loại hóa chất khác nhau mỗi ngày cho các công việc thông thường trong gia đình như dọn dẹp và chuẩn bị thức ăn. Kể từ khi có luật bảo vệ người tiêu dùng, hóa chất đều có nhãn cảnh báo độc tính, hướng dẫn về sử dụng đúng cách và cảnh báo về mối nguy hiểm của việc sử dụng không đúng cách khi sử dụng. Một số hóa chất gia dụng có thể khá nguy hiểm, đặc biệt là khi trộn lẫn với nhau. Ví dụ như phản ứng xảy ra khi trộn thuốc tẩy gia dụng (thành phần chủ yếu chứa NaClO) với ammonia (NH3). Sản phẩm phụ của phản ứng rất đa dạng tùy thuộc vào nồng độ của các chất phản ứng. Các thí nghiệm sau đây được tiến hành để xác định mức độ tại đó một số sản phẩm phụ được tạo ra từ việc trộn thuốc tẩy và ammonia.
Thí nghiệm 1
Sản phẩm phụ được biết đến của phản ứng giữa thuốc tẩy và ammonia là khí chlorine (Cl2). Khí chlorine có tác dụng mạnh có mùi khó chịu, xốc và rất độc. Xác định lượng thuốc tẩy và ammonia khi trộn lẫn với nhau, tạo ra khí chlorine, một lượng thuốc tẩy khác nhau được thêm vào 8 dung dịch ammonia 1M được sử dụng với thể tích như nhau. Dung dịch và khí chlorine thu được từ mỗi hỗn hợp đã được thu thập và đo lường. Một lượng NaClO được thêm vào từng ống dung dịch; lượng thêm vào được tăng dần cho mỗi thử nghiệm. Khối lượng khí chlorine sinh ra trong mỗi lần thử nghiệm được ghi lại và được biểu thị trong Hình 1.
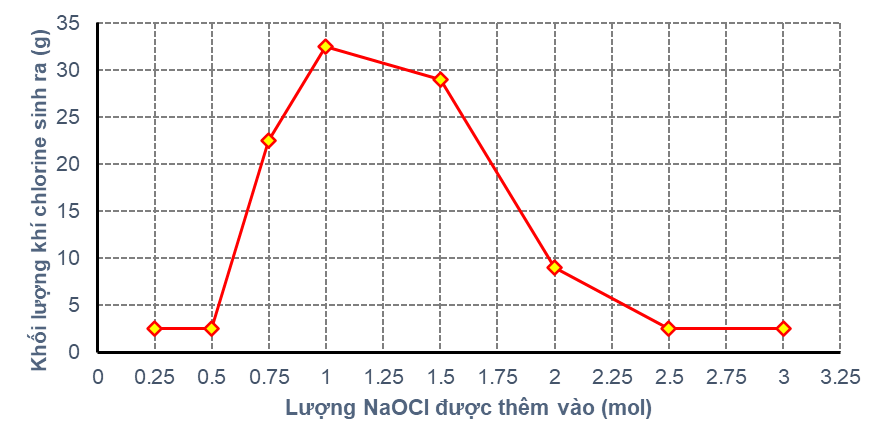
Thí nghiệm 2
Một sản phẩm phụ khác được biết đến của phản ứng thuốc tẩy và ammonia là nitrogen trichloride (NCl3). Nitrogen trichloride là chất lỏng màu vàng, nhờn, có mùi hăng, thường được tìm thấy là sản phẩm phụ của phản ứng hóa học giữa các hợp chất chứa nitrogen và chlorine. Nó có tính dễ nổ cao. Để xác định lượng thuốc tẩy và ammonia, khi trộn với nhau, tạo thành NCl3, một lượng thuốc tẩy khác nhau được thêm vào tám loại nước-ammonia khác nhau dung dịch và NCl3 thu được từ mỗi hỗn hợp là đã đo. Dung dịch NH3 1M được sử dụng trong mỗi thử nghiệm. Một số lượng nhất định NaClO được thêm vào từng dung dịch; số lượng được thêm vào được tăng dần theo từng đợt thử nghiệm. Lượng của nitrogen trichloride được tạo ra trong mỗi thử nghiệm được ghi lại trong xem bảng 1.
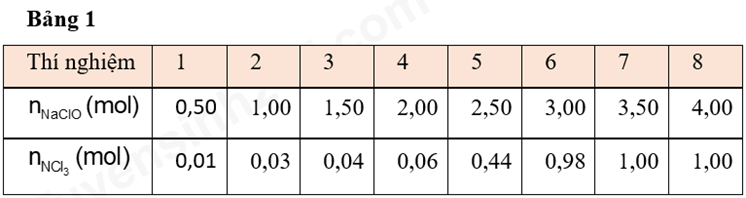
Thí nghiệm 3
Trong một phản ứng khác, thuốc tẩy và ammonia kết hợp trong những điều kiện nhất định tạo ra một hợp chất gọi là chloramin. Chloramin (NH2Cl) là chất độc hại thường được sử dụng ở nồng độ thấp làm chất khử trùng trong hệ thống nước đô thị như một giải pháp thay thế cho quá trình khử trùng bằng chlorine. Để xác định hỗn hợp thuốc tẩy và ammonia mà tại đó NH2Cl được tạo ra, một lượng ammonia khác nhau được được thêm vào 8 dung dịch nước tẩy khác nhau và thu được khí chlorine từ mỗi hỗn hợp được thu lại và đo. Dung dịch NaClO 1M được sử dụng trong mỗi thử nghiệm. Một lượng NH3 nhất định được thêm vào từng thử nghiệm; lượng ammonia thêm tăng dần theo từng đợt thử nghiệm. Lượng chloramin sinh ra trong mỗi thử nghiệm được ghi lại trong bảng 2.
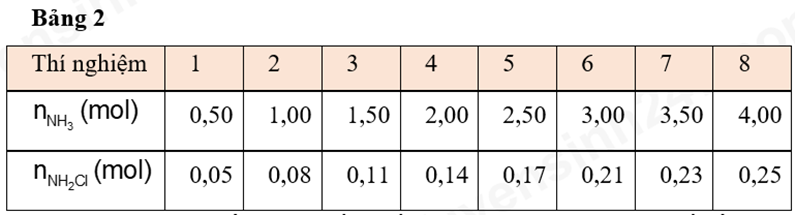
Trả lời cho các câu 1, 2, 3, 4, 5, 6, 7 dưới đây:
Lý do nào sau đây có thể xảy ra nhất khiến lượng lớn hơn 3,00 mol chất tẩy không được thử nghiệm trong thí nghiệm 1? Kết quả cho thấy
Đáp án đúng là: C
Dựa vào thí nghiệm 1.
Đáp án cần chọn là: C
Những sản phẩm phụ được tạo ra từ trộn thuốc tẩy và ammonia có thể là
Đáp án đúng là: A; B; D
Dựa vào thí nghiệm 1, 2, 3.
Đáp án cần chọn là: A; B; D
Dựa vào kết quả thí nghiệm 3, nồng độ NH3 tăng từ 0,50 lên 4,00 mol, mức tăng lớn nhất lượng NH2Cl sinh ra xảy ra:
Đáp án đúng là: C
Dựa vào thí nghiệm 3.
Đáp án cần chọn là: C
Nếu thử nghiệm thứ 9 được tiến hành trong thí nghiệm 3, việc thêm 1,25 mol NH3 vào dung dịch nước tẩy, lượng NH2Cl sinh ra sẽ gần bằng
Đáp án đúng là: B
Dựa vào thí nghiệm 3.
Đáp án cần chọn là: B
Việc sản xuất một loại nhựa nhất định đòi hỏi phải có hỗn hợp thuốc tẩy và ammonia. Tuy nhiên, sự có mặt của chlorine khí rất không mong muốn. Dựa vào kết quả của thí nghiệm 1, 2 và 3, thông số kỹ thuật nào sau đây nên được chọn biết rằng phương trình hóa học diễn ra có thể là
2NH3+ 9NaClO ⟶ 2NaNO3 + Cl2 + 7NaCl + 3H2O
Đáp án đúng là: B
Tính toán theo PTHH.
Đáp án cần chọn là: B
Trong thí nghiệm 2, các lượng NaClO khác nhau được thêm vào dung dịch ammonia dẫn đến sản xuất nitrogen trichloride. Lượng nitrogen trichloride được sản xuất cho 3,00; 3,50 và 4,00 mol NaClO được thêm vào gần như giống nhau. Dựa trên kết quả thí nghiệm, trong số điều sau điều nào giải thích rõ nhất tại sao việc tạo ra NCl3 bị hạn chế?
| Đúng | Sai | |
|---|---|---|
| a) NaClO hấp thụ thêm NH3. | ||
| b) Lượng khí chlorine sinh ra làm chậm quá trình sự phản ứng lại. | ||
| c) NaClO liên kết với H2O trong dung dịch và làm cho tốc độ phản ứng giảm. | ||
| d) Lượng NH3 dùng cho phản ứng là có hạn, và khi sử dụng hết thì phản ứng sẽ dừng lại. |
Đáp án đúng là: S; S; S; Đ
Dựa vào ngữ liệu đoạn văn.
Đáp án cần chọn là: S; S; S; Đ
Trong các đồ thị dưới đây, đồ thị nào biểu diễn hợp lí nhất sự tạo thành NH2Cl theo NH3?
Đáp án đúng là: B
Dựa và ngữ liệu đoạn 3:
Đáp án cần chọn là: B
Quảng cáo
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











