Nhỏ rất từ từ dung dịch HCl vào dung dịch chứa a mol KOH, b mol NaOH và c mol K2CO3, kết quả thí
Nhỏ rất từ từ dung dịch HCl vào dung dịch chứa a mol KOH, b mol NaOH và c mol K2CO3, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
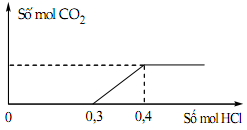
Tổng (a + b) có giá trị là
Đáp án đúng là: C
Quảng cáo
Phản ứng xảy ra theo thứ tự:
(1) H+ + OH- → H2O
(2) H+ + CO32- → HCO3-
(3) H+ + HCO3- → H2O + CO2 ↑
- Khi bắt đầu xuất hiện khí thì phản ứng (2) vừa kết thúc.
⟹ \({n_{{H^ + }}} = {n_{{H^ + }\left( 1 \right)}} + {n_{{H^ + }\left( 2 \right)}} = {n_{O{H^ - }}} + {n_{C{O_3}^{2 - }}}\)
- Khi lượng khí cực đại và không đổi thì phản ứng (3) vừa kết thúc.
⟹ \({n_{{H^ + }}} = {n_{{H^ + }\left( 1 \right)}} + {n_{{H^ + }\left( 2 \right)}} + {n_{{H^ + }\left( 3 \right)}} = {n_{O{H^ - }}} + 2{n_{C{O_3}^{2 - }}}\)
Từ đó suy ra (a + b).
Đáp án cần chọn là: C
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











