Trong một bình kín xảy ra cân bằng hoá học sau: H2(g) + I2(g) ⇌ 2HI(g). Cho 1 mol
Trong một bình kín xảy ra cân bằng hoá học sau:
H2(g) + I2(g) ⇌ 2HI(g).
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
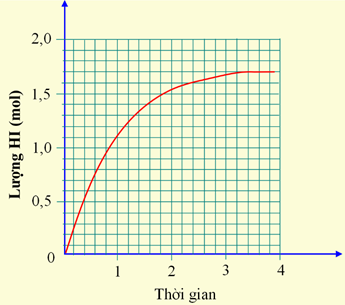
Hiệu suất của phản ứng trên là bao nhiêu?
Đáp án đúng là:
Quảng cáo
Dựa vào lí thuyết về trạng thái cân bằng của phản ứng thuận nghịch.
Đáp án cần điền là: 85
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com











