Tốc độ phản ứng và cân bằng hóa học
Chuyên đề này giúp các em giải được các bài tập về cân bằng và sự chuyển dịch cân bằng hóa học.
Lưu ý: Chức năng này hiện không còn dùng nữa, vui lòng chọn các khóa học để xem các bài giảng hoặc làm đề thi online!
Bài tập luyện
Câu hỏi số 51:
Cho các cân bằng hóa học sau: (1) H2 (k) + I2 (k) ⇄ 2HI (k) (2)  H2 (k) +
H2 (k) +  I2 (k) ⇄ HI (k) (3) 2HI (k) ⇄
I2 (k) ⇄ HI (k) (3) 2HI (k) ⇄  H2 (k) +
H2 (k) +  I2 (k) (4) 2HI (k) ⇄ H2 (k) + I2 (k) (5) H2 (k) + I2 (k) ⇄ 2HI (k) Ở nhiệt độ xác định, nếu KC của cân bằng (1) bằng 64 thì KC bằng 0,125 là của cân bằng
I2 (k) (4) 2HI (k) ⇄ H2 (k) + I2 (k) (5) H2 (k) + I2 (k) ⇄ 2HI (k) Ở nhiệt độ xác định, nếu KC của cân bằng (1) bằng 64 thì KC bằng 0,125 là của cân bằng
Câu hỏi số 52:
Cho cân bằng : N2 (k) + 3H2(k) 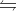 2NH3(k) Khi tăng nhiệt độ thì thì tỉ khối của hỗn hợp khí thu được so với H2 giảm. Phát biểu đúng về cân bằng này là:
2NH3(k) Khi tăng nhiệt độ thì thì tỉ khối của hỗn hợp khí thu được so với H2 giảm. Phát biểu đúng về cân bằng này là:
Câu hỏi số 53:
Có phản ứng xảy ra trong dung dịch: C2H5Br + KOH → C2H5OH + KBr Nồng độ ban đầu của KOH là 0,07M. Sau 30 phút lấy ra 10ml dung dịch hỗn hợp phản ứng thì thấy nó được trung hòa vừa đủ bởi 12,84ml dung dịch HCl 0,5M. Tốc độ trung bình của phản ứng trong khoảng thời gian trên là
Câu hỏi số 54:
Một bình phản ứng có dung tích không đổi chứa hỗn hợp khí N2 và H2 với nồng độ tương ứng là 0,3M và 0,7M. Sau khi phản ứng tổng hợp NH3 đạt trạng thái cân bằng ở t0, H2 chiếm 50% thể tích hỗn hợp thu được. Hằng số cân bằng được KC ở t0 của phản ứng có giá trị là
Câu hỏi số 55:
Để hòa tan hết một miếng kẽm trong dung dịch axit clohiđric ở 200C cần 27 phút. Nếu thực hiện thí nghiệm ở 400C thì thời gian phản ứng là 3 phút. Nếu thực hiện thí nghiệm ở 550C thì thời gian phản ứng là
Câu hỏi số 56:
Xét cân bằng hóa học của một số phản ứng sau:
1) Fe2O3 (r) + 3CO (k) 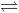 2Fe (r) + 3CO2 (k)
2) CaO (r) + CO2 (k)
2Fe (r) + 3CO2 (k)
2) CaO (r) + CO2 (k) 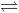 CaCO3 (r)
3) N2O4 (k)
CaCO3 (r)
3) N2O4 (k) 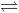 2NO2 (k)
4) H2 (k) + I2 (k)
2NO2 (k)
4) H2 (k) + I2 (k) 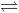 2HI (k)
5) 2SO2 (k) + O2 (k)
2HI (k)
5) 2SO2 (k) + O2 (k) 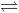 2SO3 (k)
Khi tăng áo suất, cân bằng hóa học bị chuyển dịch ở các hệ:
2SO3 (k)
Khi tăng áo suất, cân bằng hóa học bị chuyển dịch ở các hệ:
Câu hỏi số 57:
Cho cân bằng hóa học sau: CaCO3 (r) 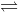 CaO (r) + CO2 (k) ΔH > 0 Trong các yếu tố:
CaO (r) + CO2 (k) ΔH > 0 Trong các yếu tố:
(1) tăng nhiệt độ;
(2) thêm một lượng CaCO3;
(3) lấy bớt CO2 ra;
(4) tăng áp suất chung của hệ.
Số yếu tố làm thay đổi cân bằng của hệ là
Câu hỏi số 58:
Nhận xét nào đúng:
Câu hỏi số 59:
Cho các cân bằng sau:
(1) H2 (k) + I2 (k) 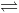 2HI (k)
(2)
2HI (k)
(2)  H2 (k) +
H2 (k) +  I2 (k)
I2 (k) 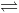 HI (k)
(3) HI (k)
HI (k)
(3) HI (k) 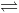
 H2 (k) +
H2 (k) +  I2 (k)
(4) 2HI (k) H2 (k) + I2 (k)
(5) H2 (k) + I2 (r)
I2 (k)
(4) 2HI (k) H2 (k) + I2 (k)
(5) H2 (k) + I2 (r) 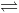 2HI (k)
Ở nhiệt độ xác định, nếu KC của cân bằng (1) bằng 64 thì KC bằng 0,125 là của cân bằng
2HI (k)
Ở nhiệt độ xác định, nếu KC của cân bằng (1) bằng 64 thì KC bằng 0,125 là của cân bằng
Câu hỏi số 60:
Phản ứng nào dưới đây chuyển dịch theo chiều thuận khi tăng áp suất hoặc giảm nhiệt độ của bình?
Còn hàng ngàn bài tập hay, nhanh tay thử sức!
>> Luyện thi tốt nghiệp THPT và Đại học, mọi lúc, mọi nơi tất cả các môn cùng các thầy cô giỏi nổi tiếng, dạy hay dễ hiểu trên Tuyensinh247.com.
 |
 |
 |
 |
 |
 |
 |
 |
Hỗ trợ - Hướng dẫn

-
024.7300.7989
-
1800.6947

(Thời gian hỗ trợ từ 7h đến 22h)
Email: lienhe@tuyensinh247.com









